
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 315 | |
| 熔点/℃ | -70.0 | ||
| 升华温度/℃ | 180 | 300 |
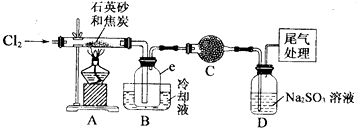
分析 (1)实验室制氯气时首先要把装置搭好,搭装置的一般顺序为从下向上,从左向右,然后检验装置的气密性,再加药品,据此答题;
(2)装置A中是用氯气与碳、二氧化硅在高温下生成四氯化硅和一氧化碳,石英砂(主要成份为含铁、铝等杂质的二氧化硅)中的铁、铝与氯气反应生成氯化铝和氯化铁会凝结成固体堵塞导管,实验中的尾气主是CO,可以用灼热的CuO除去,据此答题;
(3)根据蒸馏装置可知,蒸馏需要的仪器有圆底烧瓶、温度计、直形冷凝管、接收器;
(4)Na2S03被氧化成硫酸钠,可以通过检验硫酸根离子来证明亚硫酸钠被氧化;
(5)根据元素守恒可知,SiCl4水解可得硅酸和氯化氢,氧气与氢气能发生爆炸,同时高温下氧气能氧化硅;
解答 解:(1)实验室制氯气时首先要把装置搭好,搭装置的一般顺序为从下向上,从左向右,然后检验装置的气密性,再加药品,所以实验的操作顺序为③⑤②①,
故答案为:③⑤②①;
(2)装置A中是用氯气与碳、二氧化硅在高温下生成四氯化硅和一氧化碳,反应方程式为2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑,石英砂(主要成份为含铁、铝等杂质的二氧化硅)中的铁、铝与氯气反应生成氯化铝和氯化铁会凝结成固体堵塞导管,所以在装置A.B间导管短且粗,防止生成物的AlCl3、FeCl3等杂质凝结成固体堵塞导管,实验中的尾气主是CO,可以用灼热的CuO除去,所以在装置最后连接一个加热的装有CuO粉末的反应管,
故答案为:2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑;防止生成物的AlCl3、FeCl3等杂质凝结成固体堵塞导管;连接一个加热的装有CuO粉末的反应管;
(3)根据蒸馏装置可知,蒸馏需要的仪器有圆底烧瓶、温度计、直形冷凝管、接收器,
故答案为:CD;
(4)Na2S03被氧化成硫酸钠,可以通过检验硫酸根离子来证明亚硫酸钠被氧化,所以证明Na2S03已被氧化的方法是取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体(1分),再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体(1分),再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(5)根据元素守恒可知,SiCl4水解可得硅酸和氯化氢,氧气与氢气能发生爆炸,同时高温下氧气能氧化硅,
故答案为:H4SiO4(或H2SiO3)和HCl;可能引起爆炸、硅被氧化得不到高纯硅.
点评 本题考查了物质的转化和制备、化学方程式的书写,答题时不注意仔细观察实验装置图,解决本考点需要根据实验现象,综合分析,从而得出正确的结论,要注意知识的整体性,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=4的醋酸 | B. | pH=10的NaOH溶液 | ||
| C. | pH=9的Na2CO3溶液 | D. | pH=2的硫酸 | ||
| E. | pH=4的NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2O3(g)=3O2(g)△H<0 | B. | 2CO(g)=2C(s)+O2(g)△H>0 | ||
| C. | N2(g)+3H2(g)=2NH3(g)△H<0 | D. | CaCO3(s)=CaO(s)+CO2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( )
离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( )| A. | e电极与电源的负极相连 | |
| B. | H+在f电极上发生还原反应 | |
| C. | 精制饱和食盐水从图中b位置补充 | |
| D. | 离子交换膜的作用只是防止生成的Cl2与H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com