
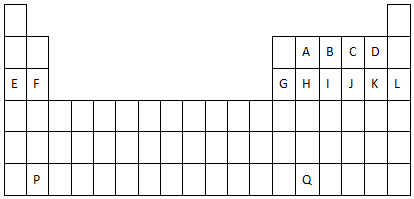
 ;
;分析 由元素在周期表中位置,可知A为碳、B为氮、C为O、D为氟、E为Na、F为Mg、G为Al、H为Si、I为磷、J为硫、K为Cl、L为Ar、P为Ba、Q为Pb.
(1)①稀有气体原子最外层为稳定结构,其化学性质最不活泼;
②同周期自左而右原子半径减小,同主族自上而下原子半径增大;
③非金属性越强,氢化物越稳定;
④最高价氧化物对应的水化物中酸性最强的是高氯酸;非金属性越强,其单质氧化性越强;
⑤非金属性越强,阴离子还原性越弱;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)F与D形成的离子化合物为MgF2,MgF2中镁离子和氟离子之间只存在离子键,为离子化合物,根据用电子式表示离子化合物方法解答;
(3)根据各周期容纳元素种数确定F、Q原子序数,F、P同主族,且处于过度元素之前,同主族相邻元素原子序数相差上一周期容纳元素种数,P、Q处于第六周期,分别处于2、14列,相差12列,其中该周期第3列容纳15种元素.
解答 解:由元素在周期表中位置,可知A为碳、B为氮、C为O、D为氟、E为Na、F为Mg、G为Al、H为Si、I为磷、J为硫、K为Cl、L为Ar、P为Ba、Q为Pb.
(1)①稀有气体原子最外层为稳定结构,故Ar化学性质最不活泼,
故答案为:Ar;
②同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述元素中Na原子半径最小,
故答案为:Na;
③同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中F的非金属性最强,非金属性越强,氢化物越稳定,故HF最稳定,
故答案为:HF;
④最高价氧化物对应的水化物中酸性最强的是高氯酸,化学式为HClO4;最高价氧化物对应的水化物中碱性最强的是高氯酸,化学式为NaOH,
故答案为:HClO4;NaOH;
⑤上述元素中F元素非金属性越强,故其阴离子F-的还原性最弱;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故上述元素形成的阳离子中Al3+半径最小,
故答案为:F-;Al3+;
(2)F与D形成离子化合物为MgF2,氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ,
,
故答案为: ;
;
(5)F、P同主族,且处于过度元素之前,同主族相邻元素原子序数相差上一周期容纳元素种数,设P的原子序数为Z,则F的原子序数为Z-8-18-18=Z-44,P、Q处于第六周期,分别处于2、14列,相差12列,其中该周期第3列容纳15种元素,故Q的原子序数=Z+15+(12-1)=Z+26,
故答案为:Z-44;Z+26.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律与化学用语考查,注意理解掌握同族元素原子序数关系,掌握列与族的关系,难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
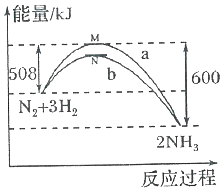 在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )
在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )| A. | 状态M和N均表示2molN(g)+6mol H(g) | |
| B. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-l | |
| C. | 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量 | |
| D. | 使用催化剂,并不能改变反应的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 乙醇溶液中:K+、H+、SO42-、MnO4- | |
| C. | 中性溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| D. | 加入铝粉后有气体产生的溶液中:Na+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的实验式:H2C═CH2 | B. | 四氯化碳的电子式: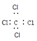 | ||
| C. | 含10个中子的氧原子:${\;}_{8}^{18}$O | D. | Al3+的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com