
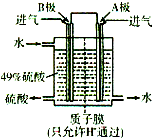
 (2012?潍坊一模)黄铁矿(Fe2S,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
(2012?潍坊一模)黄铁矿(Fe2S,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
| ||
| ||
| 32mol×22.4L |
| (8×22.4)L |
| 2mol×1.536kJ | ||
|


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
 (2012?潍坊一模)反应N2O4(g)?2NO2(g)△H=57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
(2012?潍坊一模)反应N2O4(g)?2NO2(g)△H=57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:
(2012?潍坊一模)化学与社会、生活、环境保护密切相关.下列现象或事实与解释一致的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com