
【题目】根据要求填空:
(1)A+和B-的电子层结构都与氩相同,A+的结构示意图为___;
(2)碳原子核外有___种能量不同的电子,分布在___个轨道中;
(3)鉴别碳原子可以利用其激发态原子跃迁到基态所形成的特征___(吸收或发射)光谱;
(4)水、SiO2、硫三种物质沸点由大到小的顺序为___;
(5)下列变化:H-(g)=H(g) +e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为___;
(6)短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。四种原子半径的由大到小顺序___(元素符号表示),能证明W、Z两元素非金属性强弱的离子方程式为___。
【答案】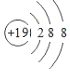 3 4 发射 SiO2>硫>水 73kJ/mol Mg>Si>S>O SiO32-+2H+=H2SiO3↓
3 4 发射 SiO2>硫>水 73kJ/mol Mg>Si>S>O SiO32-+2H+=H2SiO3↓
【解析】
根据离子核外电子排布规律画出结构示意图,判断轨道种类;根据光谱的形成原理分析解答;根据晶体的类型比较沸点大小;根据第一电离能的含义及题干信息计算第一电离能;根据核外电子排布规律推断元素种类,并根据元素周期律分析解答。
(1)设元素A的核电荷数是a,B元素原子的核电荷数为b,因为阴离子![]() 与阳离子
与阳离子![]() 电子层结构都与氩相同相同,即核外电子数相同,所以
电子层结构都与氩相同相同,即核外电子数相同,所以![]() ,
,![]() ,则
,则![]() 为
为![]() ,其结构示意图为:
,其结构示意图为: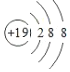 ,故答案为:
,故答案为: ;
;
(2)碳的电子排布式为![]() ,所以有3种能量不同的电子,p轨道上有2个电子,有2个纺锤形轨道,则核外共有轨道数4,故答案为:3;4;
,所以有3种能量不同的电子,p轨道上有2个电子,有2个纺锤形轨道,则核外共有轨道数4,故答案为:3;4;
(3)当碳原子从激发态跃迁到基态时,要发射能量,故答案为:发射;
(4)水常温下为液体,硫常温下为淡黄色粉末,为分子晶体,![]() 为原子晶体,水、
为原子晶体,水、![]() 、硫三种物质沸点由大到小的顺序为
、硫三种物质沸点由大到小的顺序为![]() 硫
硫![]() 水,故答案为:
水,故答案为:![]() 硫
硫![]() 水;
水;
(5)第一电离能为失去1个电子所吸收的能量,由![]() 吸收的能量为
吸收的能量为![]() ,可知氢负离子
,可知氢负离子![]() 的第一电离能为
的第一电离能为![]() ,故答案为:
,故答案为:![]() ;
;
(6)短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素;W与X属于同一主族,故W为S元素;Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素;Z单质可制成半导体材料,Z为Si元素;同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径![]() ,最高价氧化物对应水合物的酸性越强、氢化物稳定性越强,对应非金属元素的非金属性越强,在硅酸钠溶液中滴加稀硫酸,有白色沉淀生成,发生的离子反应为
,最高价氧化物对应水合物的酸性越强、氢化物稳定性越强,对应非金属元素的非金属性越强,在硅酸钠溶液中滴加稀硫酸,有白色沉淀生成,发生的离子反应为![]() ,体现硫酸酸性强于硅酸,可以证明S的非金属性大于Si,故答案为:
,体现硫酸酸性强于硅酸,可以证明S的非金属性大于Si,故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式。
(1)![]() ___;
___;
(2)![]() ___;
___;
(3)CH3CH(CH3)C(CH3)2(CH2)2CH3___;
(4)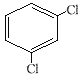 ___;
___;
(5)2,5-二甲基-4-乙基庚烷__;
(6)2-甲基-2-戊烯____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示:
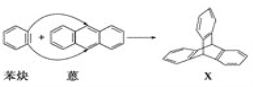
(1)蒽与X都属于___(填字母)。
a.饱和烃 b.不饱和烃
(2)苯炔的分子式为___,苯炔不具有的性质是___(填字母)。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是___(填字母,下同)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是___。
A.![]() B.C6H14 C.
B.C6H14 C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法错误的是( )
Y | |||
M | X | Z |
A.钠与Z可能形成Na2Z2化合物
B.由X与氧组成的物质在熔融时能导电
C.Y的最简单气态氢化物的热稳定性比X的强
D.M的简单离子半径是同周期中简单离子半径最小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的两物质作用时,反应条件或反应物用量的改变对生成物没有影响的是
A.Na2O2与CO2B.Na与O2C.NaOH与AlCl3D.C与O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在AlCl3溶液中滴加过量的氨水,反应的化学方程式为__________________。
(2)碳酸氢钠与稀硫酸反应的离子方程式__________________;铜与浓硫酸共热反应的化学方程式__________________。
(3)现有0.284kg质量分数为10%的Na2SO4溶液,则溶液中Na2SO4的物质的量为______;配制250mL2.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积_________mL。
(4)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子的电子层数逐渐____________,原子半径逐渐____________;失电子能力逐渐____________,金属性逐渐____________ ;得电子能力逐渐 ___________,非金属性逐渐____________ 。
(5)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;E元素原子最外层电子数比次外层电子数少1。回答下列问题:
写出E元素的元素符号:________画出B、C的原子结构示意图:B.________C________画出D的离子结构示意图:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镁原子由1s22s22p63s2→1s22s22p63p2时原子释放能量,由基态转化成激发态____。
(2)价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素______。
(3)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键______。
(4)24Cr原子的电子排布式是1s22s22p63s23p63d44s2______。
(5) 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构______。
(6)氯化钠晶体中,每个Na+周围距离相等的Na+共有12个______。
(7)金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子______。
(8) 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同______。
(9)干冰晶体中,每个CO2分子周围紧邻12个CO2分子______。
(10) 模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素形成的某种化合物(如图所示)是一种优良的防龋齿剂(用于制含氟牙膏)。下列说法错误的是( )
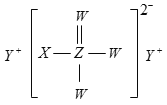
A.W、X、Y的简单离子的电子层结构相同
B.W、Y形成的化合物中只含离子键
C.该化合物中Z不满足8电子稳定结构
D.X、Y形成的化合物溶于水能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现铂的两种化合物a和b(见图),实验测得a和b具有不同的性质,且a具有抗癌作用,而b没有。下列关于a、b的叙述错误的是 ( )

A.a和b互为同分异构体B.a和b的空间构型是平面四边形
C.a和b互为镜像的关系D.a和b分别是非极性分子和极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com