
| A.100KJ | B.60KJ | C.50KJ | D.30KJ |
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)= SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2= O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.自发反应一定是放热反应 |
| B.自发反应一定是吸热反应 |
| C.有的吸热反应也能自发进行 |
| D.吸热反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32- |
B.热化学方程式C2H2(g)+ O2(g) O2(g) |
C.铂电极电解MgCl2饱和溶液:MgCl2 |
| D.H+(aq)+OH(aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
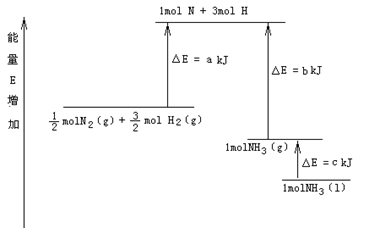
| A.1/2 mol N2和3/2 mol H2转变为原子是放出能量a KJ |
| B.1mol N 和3mol H结合成1mol NH3(g)时放出热量b KJ |
| C.1mol NH3(l)转变为1mol NH3(g)时放出热量 c KJ |
| D.1/2 mol N2和3/2 mol H2反应生成1mol NH3(l)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
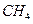 (g)+
(g)+ 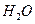 (g)====
(g)====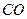 (g)+
(g)+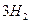 (g)
(g)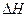 =
= 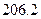
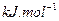
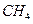 (g)+
(g)+ 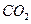 (g)====
(g)==== (g)+
(g)+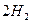 (g)
(g)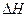 =
= 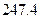
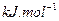
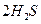 (g)====
(g)====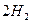 (g)+
(g)+ (g)
(g) 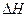 =
= 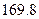
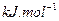
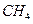 (g)与
(g)与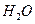 (g)反应生成
(g)反应生成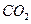 (g)和
(g)和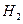 (g)的热化学方程式为______。
(g)的热化学方程式为______。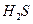 热分解制氢时,常向反应器中通入一定比例空气,使部分
热分解制氢时,常向反应器中通入一定比例空气,使部分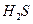 燃烧,其目的是_____;燃烧生成的
燃烧,其目的是_____;燃烧生成的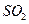 与
与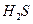 进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_______。
进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_______。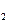 O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_______。
,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_______。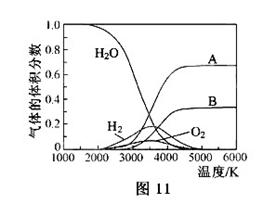
 )
) ]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_______。
]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_______。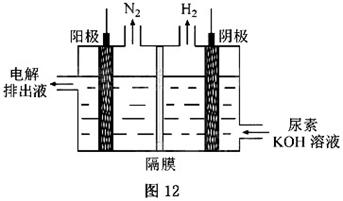
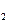 Cu是一种储氢合金。350℃时,Mg
Cu是一种储氢合金。350℃时,Mg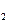 Cu与H
Cu与H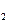 反应,生成MgCu
反应,生成MgCu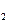 和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg
和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg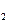 Cu与H
Cu与H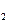 反应的化学方程式为_______。
反应的化学方程式为_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
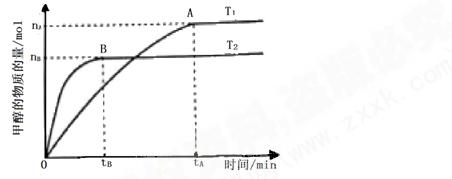
 号)
号) mol·L-1·min-1
mol·L-1·min-1 增大
增大查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.已知298K时,2SO2(g)+O2(g)  2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ 2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol |
| C.吸热反应是指反应物所具有的总能量低于生成物所具有的总能量,而不是看反应过程是否需要加热 |
| D.对下列反应:HCl(aq) + NaOH(aq)="NaCl(aq)" + H2O(l)△H=-Q1kJ/mol |
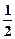 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= 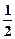 Na2SO4(aq)+H2O(l) △H=-Q2kJ/mol
Na2SO4(aq)+H2O(l) △H=-Q2kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com