
(15分)
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据下表中数据,在答题卡该题相应位置上画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是___________________________;
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(4)该反应达到平衡时反应物X的转化率a等于___________________________;
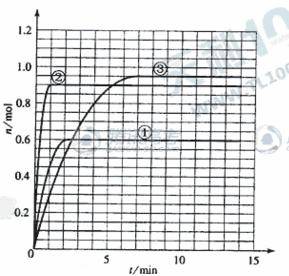
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如右图所示)则曲线1、2、3所对应的实验条件改变分别是:
①_________________ ②_______________ ③__________________
科目:高中化学 来源:2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷 题型:填空题
(每空格3分,计15分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 B.密闭容器中总压强不变
B.密闭容器中总压强不变查看答案和解析>>
科目:高中化学 来源:2012届浙江省绍兴一中高三5月模拟考试理科综合化学试卷(带解析) 题型:填空题
(15分)氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇,在工业上用作酸性清洗剂、阻燃剂、磺化剂等。市售商品为白色粉末,在常温下,只要保持干燥不与水接触,固体的氨基磺酸不吸湿,比较稳定。它具有不挥发、无臭味和对人体毒性极小的特点。某实验组用尿素和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下 “磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g)  H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
(1)下图是“磺化”过程的实验装置,恒压滴液漏斗的作用是 ____________
(2)抽滤时,所得晶体要用溶剂乙醇洗涤,则洗涤的具体操作是
(3)实验过程的讨论分析:
①重结晶时用溶剂甲(10%~12%的硫酸)作重结晶的溶剂用而不用水作溶剂的原因是
② “磺化”过程温度与产率的关系如图(1),控制反应温度为75~80℃为宜,若温度高于80℃,氨基磺酸的产率会降低,原因是 。
(4)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2000mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。
①以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有 _____ 杂质。
②写出NaNO2滴定法中的化学方程式为: 。
③试求产品中氨基磺酸的质量分数__________________________。
查看答案和解析>>
科目:高中化学 来源:2010年西藏拉萨中学高三下学期第七次月考(理综)化学部分 题型:实验题
(15分)现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸n mol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。

请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是
。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有 。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号) 。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:
(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为 ;相同条件下,当起始时同时通入a mol SO2、b mol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)(1)右图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中能量变化示意,请写出
过程中能量变化示意,请写出![]() 和
和![]() 反应的热化学方程式_________________________________。
反应的热化学方程式_________________________________。
(2)已知下列热化学方程式:
![]()
![]() =-393.5 kJ?mol-1
=-393.5 kJ?mol-1
![]()
![]() =-483.6 kJ?mol-1
=-483.6 kJ?mol-1
![]()
![]() =-283.0 kJ?mol-1
=-283.0 kJ?mol-1
由此可知反应:![]() 9
9![]() 的焓变为_________。
的焓变为_________。
 (3)某温度时
(3)某温度时![]() 在水中的沉淀溶解平衡曲线如同所示。(提示
在水中的沉淀溶解平衡曲线如同所示。(提示![]() ⇋
⇋![]() (aq)的平衡秆数
(aq)的平衡秆数![]() ?
?![]() ,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
A.加入![]() 可以使溶液由a点变到b点
可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无![]() 沉淀生成
沉淀生成
D.a点对应的![]() 等于c点对应的
等于c点对应的![]()
(4)在一固定体积的密闭容器中,进行如下化学反应:
![]()
![]() <0,其化学平衡常数K与t关系如下表:
<0,其化学平衡常数K与t关系如下表:
t/K | 298 | 398 | 498 | …… |
K/(mol?L | 4.1× | K | K | …… |
请完成下列问题:
①试比较K![]() 、K
、K![]() 的大小,K1_______K2(填写“>”“=”或“<”)
的大小,K1_______K2(填写“>”“=”或“<”)
②下列各项能作为判断浚反应达到化学平衡状态的依据的是__________(填字母序号)。
A.容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2 B.
的浓度之比为1:3:2 B. ![]()
C.容器内坼强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改蛮 E.混合气体中各成分的浓度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com