
����Ŀ������ǰ20��Ԫ���еIJ���Ԫ�ص�һЩ���ݣ�
A | B | C | D | E | F | G | H | I | J | |
ԭ�Ӱ뾶��10��10 m�� | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
���̬ | +6 | +1 | �� | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
��ͼ�̬ | ��2 | �� | ��2 | �� | ��4 | ��3 | ��1 | �� | ��3 | ��4 |
�Իش��������⣺
��1������10��Ԫ�ص縺������������Ԫ�ط��ţ�����Ԫ��Bԭ��������7��Ԫ����Ԫ�����ڱ��е�λ�ã������ڣ����壬���̬ԭ�ӵĺ�������Ų�ʽ�� ��
��2��H��I��J����Ԫ�ض�Ӧ���ʵ��۵��������ߵ�˳���ǣ��õ��ʵľ��廯ѧʽ���� ��
��3��Ԫ��E��C����Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӣ�������й��γ����Ҽ������м���
��4��I����Ԫ���γɵ�10���ӷ���X�Ŀռ乹��Ϊ����X����ˮ�����Һ���뵽CuSO4��Һ�����������õ��������ӵĻ�ѧʽΪ �� ����X��Cu2+֮��������ϣ�
��5����ͼ1��IԪ���γɵĺ�����Ľṹ�����Ҫ˵��������������ˮ��ԭ�� a��
b��
��6����ͼ2��J��E��ɵľ���ṹ����ÿ����J��Χ���Jԭ����ĿΪ �� �������߳�Ϊa cm��������ܶ�Ϊ���ú�a��NA�Ĵ���ʽ��ʾ����g/mL�� 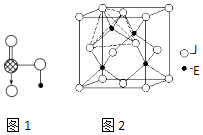
���𰸡�
��1��O��4��VIII��1s22s22p63s23p63d64s2����[Ar]3d64s2��
��2��N2��Na��Si
��3��7��1
��4�������Σ�[Cu��NH3��4]2+����λ
��5��HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У�HNO3�����еĩ�OH����ˮ����֮���γ����
��6��12��![]() ��
�� ![]() ��
�� ![]()
���������⣺��1��ͬ����������ҵ縺�Գ��������ƣ�ͬ�������϶��µ縺�Լ�С��������Ԫ���е縺������Ԫ������Ԫ�أ���Ԫ��Bԭ��������7��Ԫ��ΪFe�����ڵ�������VIII�壻��̬ԭ�Ӻ�������Ų�Ϊ��1s22s22p63s23p63d64s2����[Ar]3d64s2�����ʴ���Ϊ��O��4��VIII��1s22s22p63s23p63d64s2����[Ar]3d64s2������2��HΪNa��I��N��J��Si���䵥�ʵ��۵��������ߵ�ΪN2��Na��Si��
���Դ��ǣ�N2��Na��Si����3��̼Ԫ�ء���Ԫ�ؼ���Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӣ�������ΪCH3COOH��������й��γ�7���Ҽ���1���м���
���Դ��ǣ�7��1����4��XΪNH3 �� NH3�е�ԭ�ӵļ۲���Ӷ���Ϊ ![]() =4����һ�Թµ��Ӷԣ�����NH3�ռ乹��Ϊ�����Σ���NH3����ˮ�����Һ���뵽CuSO4��Һ�����������õ������ӵĻ�ѧʽΪ[Cu ��NH3��4]2+ �� ����NH3��Cu2+֮������λ����ϣ�
=4����һ�Թµ��Ӷԣ�����NH3�ռ乹��Ϊ�����Σ���NH3����ˮ�����Һ���뵽CuSO4��Һ�����������õ������ӵĻ�ѧʽΪ[Cu ��NH3��4]2+ �� ����NH3��Cu2+֮������λ����ϣ�
���Դ��ǣ������Σ�[Cu ��NH3��4]2+����λ����5��ͼ1�еĺ�����ΪHNO3 �� HNO3������ˮ��ԭ��a��HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У�b��HNO3�����еĩ�OH����ˮ����֮���γ������
���Դ��ǣ�HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У� HNO3�����еĩ�OH����ˮ����֮���γ��������6��J��Si��E��C���Ծ��������ϵ�SiΪ������֮���������SiΪ12��������Siԭ����ĿΪ8�� ![]() +6��
+6�� ![]() =4��������Cԭ����ĿΪ4�������߳�Ϊa cm���������Ϊa3 �� ������ܶ�Ϊ
=4��������Cԭ����ĿΪ4�������߳�Ϊa cm���������Ϊa3 �� ������ܶ�Ϊ ![]() g/mL=
g/mL= ![]() g/mL=
g/mL= ![]() g/mL��
g/mL��
���Դ��ǣ�12�� ![]() ��
�� ![]() ��
�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10L�ܱ������м���5mol SO2��4mol O2 �� ��10min��Ӧ��ƽ��ʱ��3mol SO2�����˷�Ӧ���Լ��㣺
��1����SO2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ���٣�
��2��O2��ת����Ϊ���٣�
��3��ƽ�ⳣ��KΪ���٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ձ���ʢ�Ķ��Ǻ�ˮ���������б���ʴ�������ɿ쵽����˳��Ϊ�� �� 
A.�ۢܢڢ�
B.�ۢܢ٢�
C.�ܢڢ٢�
D.�ڢ٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ի��CO��H2����Ҫ����ԭ�ϣ���ط�Ӧԭ�����£� ��CH4��g��+ ![]() O2��g��CO��g��+2H2��g����H=��36kJ/mol
O2��g��CO��g��+2H2��g����H=��36kJ/mol
��CH4��g��+H2O��g��CO��g��+3H2��g����H=+206kJ/mol
��CH4��g��+CO2��g��2CO��g��+2H2��g����H=+247kJ/mol����Ӧ
��CH4��g��+2O2��g��CO2��g��+2H2O ��g����H=��889.6kJ/mol
��1����ӦCO2 ��g��+H2��g��CO ��g��+H2O��g����H= ��
��2��ij�¶��£������Ϊ1L���ܱ������г���1molCH4��1molCO2 �� ֻ������Ӧ�ۣ����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��1����ʾ������0��5СʱH2��ƽ����Ӧ���� �� ���¶��µ�ƽ�ⳣ��Ϊ��������λ��Ч���֣��������������г�0.4molCH4��0.2molCO�������������䣬��ƽ���������ƶ���
��3���о���Ա�о�������������������CO��H2����Ӱ�죬�ڳ�ʼ�¶�Ϊ973Kʱ��n��O2��/n��H2O������ͬ����Ͷ�벻ͬ��Ӧ���������ȣ�������ͬ��ʱ�䣬������������ͼ��2������ͼ��֪��������CO�ĺ����� ![]() �������������Ҫԭ���� ��
�������������Ҫԭ���� ��
��4������������ѡ������NiO��Al2O3��Ϊ��������ҵ�ϳ���Ni��NO3��2��Al��NO3��3���Һ���백ˮ����pH=12�����£���Ȼ����Һ��ѹ���·��ü����յȲ����Ʊ������백ˮ����pH=12ʱ��c��Ni2+��Ϊ �� ��֪��Ksp[Ni��OH��2]=5��10��16 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��198KʱN2��H2��Ӧ�����������仯������ͼ������������ȷ���ǣ� �� 
A.�÷�Ӧ���Ȼ�ѧ����ʽΪN2+3H22NH3��H=��92 kJmol��1
B.a�����Ǽ������ʱ�������仯����
C.����������û�ѧ��Ӧ�ķ�Ӧ�ȸı�
D.�����¶ȣ���Ӧ���ʼӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ü۲���ӶԻ��������ж�SO3�ķ��ӹ���( )
A.����������
B.V��
C.������
D.ƽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ѷ���һ����������ӣ��仯ѧʽΪH3 �� ����ͬ�����£���������H3��H2��ͬ���ǣ�������
A.ԭ����
B.������
C.���
D.���ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����Ҫ�Ļ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ��������˵��������ǣ� ��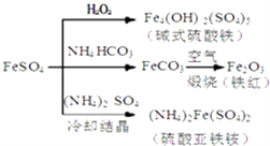
A.��ʽ������ˮ���ܲ���Fe��OH��3���壬��������ˮ��
B.Ϊ��ֹNH4HCO3�ֽ⣬����FeCO3���ڽϵ��¶��½���
C.����KSCN��Һ���飨NH4��2Fe��SO4��2�Ƿ�����
D.�����£���NH4��2Fe��SO4��2��FeSO4������ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com