
| A.向H2S水溶液中加入NaOH固体有利于S2-增多 |
| B.鼓入过量空气有利于SO2转化为SO3 |
| C.高压对合成氨有利 |
| D.500℃左右比室温更有利于氨的合成 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol?L-1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol?L-1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
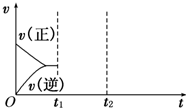
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.降低温度和增大压强 | B.降低温度和减小压强 |
| C.升高温度和减小压强 | D.升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D | |
| H2 | 6 | 1 | 3.5 | 5 |
| N2 | 2 | 0 | 1 | 1.5 |
| NH3 | 0 | 4 | 2 | 1 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
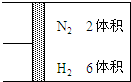
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入催化剂,反应途径将发生改变,△H也将随之改变 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com