
����Ŀ����֪Fe2O3��s��+3CO��g��2Fe��s��+3CO2��g���ڲ�ͬ�¶��µ�ƽ�ⳣ�������
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 42.9 | 50.7 | 64.0 |
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= ______ ����H ______ 0����������������������=������
��2����һ���ݻ�Ϊ10L���ܱ������У�1300��ʱ����Fe��Fe2O3��CO��CO2��1mol����Ӧ����10min��ﵽƽ�⣮���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����v��CO2��= ______ ��CO��ƽ��ת����Ϊ ______��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ______��
A������Fe2O3����B��������ʵĴ���C���Ƴ�����CO2D����߷�Ӧ�¶ȣ�
���𰸡� 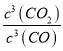 �� 0.006mol/��Lmin�� 60% CD
�� 0.006mol/��Lmin�� 60% CD
�������������������1������ƽ�ⳣ����������������¶Ⱥ�ƽ�ⳣ���Ĺ�ϵ���
��2������ƽ�ⳣ���������ʽ���㣻
��3���������������ƽ��״̬��Ӱ�������
��������1����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ����˸��ݷ���ʽ��֪�÷�Ӧ��ƽ�ⳣ������ʽ K��![]() �����ݱ������ݿ�֪�����¶�ƽ�ⳣ��������˵�������¶�ƽ��������Ӧ������У�������Ӧ�����ȷ�Ӧ������H��0��
�����ݱ������ݿ�֪�����¶�ƽ�ⳣ��������˵�������¶�ƽ��������Ӧ������У�������Ӧ�����ȷ�Ӧ������H��0��
��2�� Fe2O3(s)��3CO(g) ![]() 2Fe(s)��3CO2(g)
2Fe(s)��3CO2(g)
��ʼŨ�ȣ�mol/L�� 0.1 0.1
ת��Ũ�ȣ�mol/L�� x x
ƽ��Ũ�ȣ�mol/L�� 0.1-x 0.1+x
�����ƽ�ⳣ����֪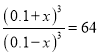 �����x��0.06�����ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���� v(CO2)��0.06mol/L��10min��0.006mol/(L��min)��CO��ƽ��ת����Ϊ
�����x��0.06�����ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���� v(CO2)��0.06mol/L��10min��0.006mol/(L��min)��CO��ƽ��ת����Ϊ![]() ��
��
��3��A�����ӹ���Fe2O3�������ܸı�ƽ��״̬��ת���ʲ��䣬A����B��������ʵĴ������ܸı�ƽ��״̬��ת���ʲ��䣬B����C���Ƴ�����CO2������������Ũ�ȣ�ƽ��������Ӧ������У�ת������ߣ�C��ȷ��D������Ӧ���ȣ���߷�Ӧ�¶ȣ�ƽ��������Ӧ������У�ת������ߣ�D��ȷ����ѡCD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ������Ļ�ѧ�ң�1991����ȷ���In�����ԭ������Ϊ114.818�����������ԭ������ίԱ�����Ϊ�µı�ֵ���������ԭ�����������״β����ҹ��ⶨ�����ԭ������ֵ�������й��� ![]() In��˵���У�������ǣ� ��
In��˵���У�������ǣ� ��
A.![]() Inԭ�Ӻ�����49������
Inԭ�Ӻ�����49������
B.![]() Inԭ�Ӻ�����49������
Inԭ�Ӻ�����49������
C.![]() Inԭ�Ӻ�����������������֮�͵�������������Ϊ115
Inԭ�Ӻ�����������������֮�͵�������������Ϊ115
D.![]() In��InԪ�ص�һ�ֺ���
In��InԪ�ص�һ�ֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����( )
A. ʳ��ˮ B. ϡ���� C. CuSO4 ��Һ D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������һ����ȷ������ ��
A. һ��������ij�ܱ�����ʢ2 mol N2��3 mol H2��Ӧ���ɵ�NH3������Ϊ2NA
B. 25 ��ʱ��Ksp(BaSO4)��1��10��10����BaSO4������Һ��Ba2����ĿΪ1��10��5NA
C. һ��������4.6g Na��ȫ��O2��Ӧ����7.2 g���ʧȥ�ĵ�����Ϊ0.2NA
D. 1 L 0.1mol��L��1��NaHCO3��Һ��HCO![]() ��CO
��CO![]() ��������֮��Ϊ0.1NA
��������֮��Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��Ӧ2H2��g��+O2��g���T2H2O��g���������仯ʾ��ͼ������˵����ȷ���ǣ�������
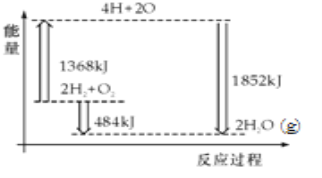
A. H2��g����O2��g����Ӧ����H2O��g �����������ȷ�Ӧ
B. 2mol H2��1mol O2ת��Ϊ4mol H��2mol Oԭ�ӵĹ����зų�����
C. 2mol H2��g����1mol O2��g����Ӧ����2mol H2O��g�������ų�484kJ����
D. 4mol H��2mol O����2mol H2O��g�������ų�484kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����KClO3+6HCl=KCl+3Cl2��+3H2O�ķ�Ӧ�У�������²���6.72LCl2 ��
��1����˫���ű�ʾ������Ӧ��ʧ���ӵ��������ָ���������ͻ�ԭ��
��2�����㱻������HCl�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ�Ͻ����Ӳ�����ɡ����ۡ��ྻ�����ڼӹ�����Ϊ���ͽ���װ����ϣ���Ҫ���������������š��������ȣ���������Щ��;�ص������ǣ�������
A.�����Ժ�B.��������C.����Ⱥ�D.ǿ�ȸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(PH3)��һ��ǿ�ҵĴ�������ɱ��������ȡԭ��������ʵ�����ư�������������������ﵽ2PPM�����Ǿͻ���������ж�..,��ش�
��1���õ⻯��(PH4I)���ռӦ��ȡPH3�Ļ�ѧ����ʽ______��
��2��ʵ����������ͭ��Һ����PH3ʱ�Ļ�ѧ����ʽ24CuSO4+11PH3+12H2O=8Cu3P��+3H3PO4+24H2SO4 ����������______��������2.2molPH3ת�Ƶ���______mol
��3������̼��COS������������������Ѭ��������ĩ״��KSCN��Ũ������һ�������¿ɵõ�COS�������������Σ�����������ʵ���֮��Ϊ1��1��1,д����Ӧ�Ļ�ѧ����ʽ______��
��4������̼ˮ�⼰����Ӧ���������£����ֲ�������ȥ����
COS![]() H2S
H2S![]() Na2S
Na2S![]() M��Һ+H2
M��Һ+H2
���������̼������ĸ�ԭ���У�ԭ�Ӱ뾶����Ԫ�������ڱ��е�λ����_______.
����֪M��Һ����Ԫ�ص���Ҫ������ʽΪS2O32������Ӧ��������S2O32�������ӷ���ʽΪ___��
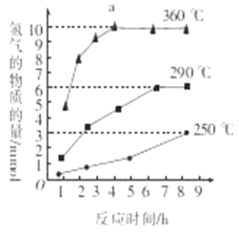
����ͼ�Ƿ�Ӧ���У��ڲ�ͬ��Ӧ�¶��£���Ӧʱ����H2�����Ĺ�ϵ��Na2S��ʼ����Ϊ3mmol������ͼ�������֪��a��ʱM��Һ�г�S2O32���⣬����____������������ӷ��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǿ����ʵĻ����Һ10L�����п��ܺ���K+��Ba2+��Na+��NH4+��Cl-��SO42-��AlO2-��OH-�еļ��֣�������ͨ��CO2���壬��������������ͨ��CO2����֮��Ĺ�ϵ��������ʾ������˵����ȷ����
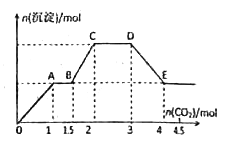
A. ����Һ����ȷ�����ڵ�������Ba2+��AlO2-��NH4+
B. �϶������ڵ�������SO42-��OH-
C. ������ȷ�������������ٻ�������һ�������ӣ�������ӵ���СŨ��Ϊ0.2 mol/L
D. OA�η�Ӧ�����ӷ���ʽ��2 AlO2-+ CO2+3H2O=2Al(OH)3��+CO32-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com