
【题目】某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是( )
A.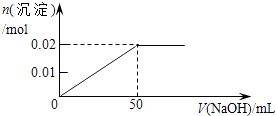
B.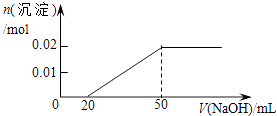
C.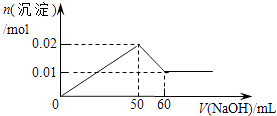
D.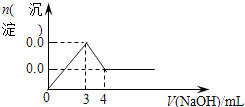
【答案】C
【解析】解:含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,发生反应Al3++3OH﹣═Al(OH)3↓,得到沉淀0.01mol,消耗氢氧化钠0.03mol,即30mL,Mg2++2OH﹣═Mg(OH)2↓,得到次沉淀0.01mol,消耗氢氧化钠0.02mol,即20mL,随反应进行沉淀量增大,共消耗氢氧化钠50mL,0.01mol氢氧化铝会溶于过量的氢氧化钠中,Al(OH)3↓+OH﹣═AlO2﹣+2H2O,消耗氢氧化钠10mL,故沉淀达最大值后,再加氢氧化钠,沉淀量减小,直到最后剩余的是氢氧化镁沉淀0.01mol.故选C.
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,再继续滴加NaOH溶液时,氢氧化铝 会完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液.


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_____________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是______________________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是____________,c中加入的试剂是____________,d中加入的试剂是____________,实验现象为____________________________________________。有同学认为,该实验装置仍不能证明上述结论,改进的措施是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碘水中加入适量CCl4振荡,静置后可观察到的现象为
A. 不分层,溶液呈紫色 B. 不分层, 溶液呈棕色
C. 分层,上层为紫色 D. 分层,下层为紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用烃A合成高分子化合物N的流程如图:
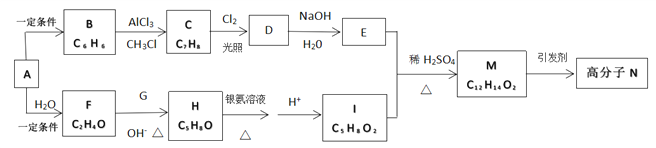
经测定烃A在标准状况下的密度为1.16 g.L-1,F和G是同系物,核磁共振氢谱显示有机物H中有四种峰,且峰值比为3:3:1:1。已知:
Ⅰ.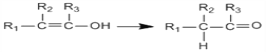 Ⅱ.
Ⅱ.![]()
Ⅲ.![]() (R1、R2、R3代表烃基或氢原子)回答下列问题:
(R1、R2、R3代表烃基或氢原子)回答下列问题:
(1)写出A的结构简式_________________。
(2)H中所含官能团的名称是_______________________。
(3)写出F和G反应生成H的化学方程式______________________________________。
(4)M→N的反应类型是________________;写出H与银氨溶液反应的化学方程式_____________________________________。
(5)E和I反应生成M的化学方程式为________________________________________。
(6)芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成2-丙醇,则Q的种类有_________________________种。(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着电子设备、电动工具、小功率电动汽车等迅猛发展,钠离子电池有望取代锂离子电池成为未来化学电源的新宠。新一代钠电池的反应为NaxMnO2+Na3Sb![]() NayMnO2+Sb (未配平),该电池以含Na+的导电固体为电解质,下列说法合理的是
NayMnO2+Sb (未配平),该电池以含Na+的导电固体为电解质,下列说法合理的是
A. 合金Na3Sb,Na显+1价,Sb显-3 价
B. 放电时每消耗1mol Na3Sb,有3mol Na+从正极移向负极
C. 可用饱和食盐水代替导电固体电解质
D. 放电时正极反应式为NaxMnO2+( y-x) e-+( y-x) Na+==NayMnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
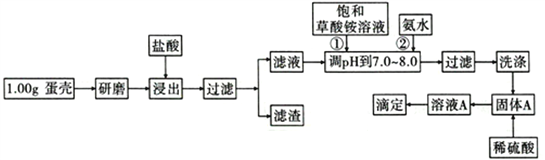
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________________________________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________________。
(3)洗涤最好选用_____(填“冰水”或“0. lmol/L草酸铵溶液”),其目的是____________________。
(4)在一定温度下,向2L的密闭容器中放入足量的草酸钙(固体所占体积忽略不计)发生反应: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
(5)滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。 步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消粍KMnO4溶液V1mL。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol /L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为____________________。
②滴定终点的现象是________________________________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_________实际值(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3和K2CO3为电解质、以CH4为燃料,该电池的工作原理如下图所示,下列说法正确的是
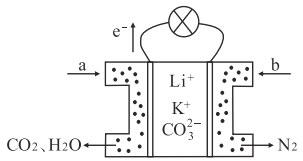
A. 电极a为负极,发生氧化反应 B. CO32-向正极移动
C. 正极电极反应式为O2+2H2O+4e-=4OH- D. 此电池在常温下也能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,可能大量共存的是( )
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下, Kw/c(H+)=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com