
【题目】在四个不同容器中,不同条件下进行反应N2+3H22NH3,根据在相同时间内测定的结果,判断该反应的速率最大的是( )
A. υ(NH3)=0.5molL﹣1min﹣1
B. υ(H2)=0.3molL﹣1min﹣1
C. υ(N2)=0.2molL﹣1min﹣1
D. υ(H2)=0.01molL﹣1s﹣1
【答案】A
【解析】
反应为N2(g)+3H2(g)![]() 2NH3(g),以氢气的反应速率为标准进行判断,注意速率的单位转化为mol/(Lmin)。
2NH3(g),以氢气的反应速率为标准进行判断,注意速率的单位转化为mol/(Lmin)。
A. υ(NH3)=0.5mol/(Lmin),反应速率之比等于其计量数之比,所以ν(H2)=0.75mol/(Lmin);
B.ν(H2)=0.3mol/(Lmin);
C.ν(N2)=0.2mol/(Lmin),反应速率之比等于其计量数之比,所以ν(H2)=0.6mol/(Lmin);
D. ν(H2)=0.01mol/(Ls)=0.6mol/(Lmin),
可见用氢气表示的反应速率,反应速率最快的是0.75mol/(Lmin);
因此合理选项是A。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,下列选项所示物质间转化均能一步实现的是( )
A.Cl2→HCl→NaClOB.Al→NaAlO2→Al(OH)3
C.Cu→CuO→Cu(OH)2D.Fe→Fe(OH)3→FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2+不稳定,极易被氧气氧化,不与锌反应。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示。制备过程中发生的相关反应如下所示:
Zn+2HCl===ZnCl2+H2↑
Zn+2CrCl3===2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O===[Cr(CH3COO)2]2·2H2O(晶体)
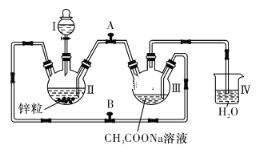
试回答下列问题:
(1)本实验中配制溶液所用的蒸馏水需事先煮沸,原因是__________。
(2)往仪器Ⅱ中加盐酸和CrCl3溶液的顺序最好是__________________________,理由是____________。
(3)为使生成的CrCl2溶液与CH3COONa溶液混合,应关闭阀门____(填“A”或“B”,下同),打开阀门_____。
(4)本实验中锌粒要过量,其原因除了使锌与CrCl3充分反应得到CrCl2外,另一个作用是________。仪器Ⅳ的主要作用是___________。
(5)已知实验时取用的CrCl3溶液中含溶质9.51 g,取用的CH3COONa溶液为1.5 L 0.1 mol/L,其他反应物足量。实验后得干燥的[Cr(CH3COO)2]2·2H2O 9.4 g,则该实验所得产品的产率为________(用百分数表示,保留3位有效数字)(不考虑溶解的醋酸亚铬水合物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①H2(g)+![]() O2(g)
O2(g) ![]() H2O(g);ΔH1= a kJ·mol-1
H2O(g);ΔH1= a kJ·mol-1
②2H2(g)+O2(g) ![]() 2H2O(g);ΔH2= b kJ·mol-1
2H2O(g);ΔH2= b kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l);ΔH3= c kJ·mol-1
H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g)![]() 2H2O(l);ΔH4= d kJ·mol-1
2H2O(l);ΔH4= d kJ·mol-1
下列关系正确的是( )
A. c<a <0 B. b>a > 0 C. 2a=d <0 D. 2c=d >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2X(g) + Y(g) ![]() 3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入 X :______________;
(5)加入 Y :______________;
(6)压缩体积:______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
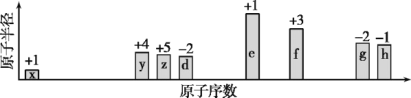
根据判断出的元素回答问题:
(1)h在周期表中的位置是_______。
(2)比较d、f离子半径大小(用化学式表示,下同):_>_。g、h的最高价氧化物对应水化物的酸性强弱:__ >__。
(3)h的单质与e的最高价氧化物对应水化物反应的离子方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com