
已知短周期的主族元素X、Y、Z、W、M的原子序数依次增大,X 是常见化肥的主要元素,Y 原子的最外层只有2个电子,Z单质可制成半导体材料,W元素形成的单质为黄色的固体。请回答以下问题:
(1)元素W在周期表的位置为 ;
(2)X与Y形成的化合物的电子式 ;
(3)Z的氧化物晶体类型为 ,12gZ的氧化物中含有的共价键数为 ;
(4)X、W形成的氢化物分别为甲和乙,且甲、乙所含的电子数相等,则甲的结构式为 ;
(5)W和M都是较活泼的非金属元素,用实验事实表明这两种元素的非金属性强弱 (用方程式书写或文字说明)。
(1)第三周期ⅥA族;
(2)
(3)原子晶体,0.8NA
(4)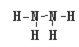
(5)Cl2+H2S=S+2HCl
【解析】
试题分析:X 是短周期元素,还是常见化肥的主要元素,可以判断出X为氮元素;Y 原子的最外层只有2 个电子,不难看出Y为镁元素;Z单质可制成半导体材料,Z为硅元素;W元素形成的单质为黄色的固体,为硫元素。(1)硫元素在元素周期表中的位置第三周期ⅥA族;(2)氮化镁为离子化合物,电子式: 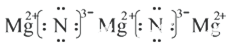 ;(3)二氧化硅属于原子晶体,1mol二氧化硅含4molSi-O键,0.2mol二氧化硅含0.8molSi-O键;(4)18电子微粒,肼结构式
;(3)二氧化硅属于原子晶体,1mol二氧化硅含4molSi-O键,0.2mol二氧化硅含0.8molSi-O键;(4)18电子微粒,肼结构式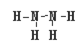 ;(5)氧化剂的氧化性大于氧化产物,Cl2+H2S=S+2HCl。
;(5)氧化剂的氧化性大于氧化产物,Cl2+H2S=S+2HCl。
考点:考查元素周期表和元素周期律相关知识,涉及到电子式、结构式书写,化学键计算等。


科目:高中化学 来源: 题型:


| ||
| ||
 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com