
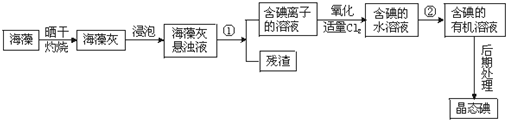


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
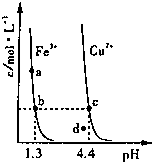 某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是| A、Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| B、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| C、d点所代表的Cu(OH)2溶液达到了饱和 |
| D、向含有相同浓度Fe3+和Cu2+的混合溶液中逐滴滴加NaOH溶液,先形成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、加入等质量的铁粉,反应过程中放出H2的速率相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m<n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com