
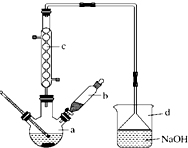
 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
分析 (1)苯与液溴发生取代反应生成溴苯和HBr,HBr易结合水蒸气形成白雾,装置d可吸收尾气;
(2)NaOH可吸收溴、HBr,粗溴苯中加入少量的无水氯化钙,可吸收水;
(3)分液得到粗溴苯中还含有的主要杂质为苯,二者互溶,但沸点不同;
(4)15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴,可知烧瓶中液体体积19mL左右,液体体积不能超过a的容积的$\frac{1}{3}$.
解答 解:(1)向a中滴加几滴溴,有白雾产生,是因为生成了HBr气体,苯与液溴发生取代反应生成溴苯和HBr,可知a中发生反应的化学方程式为反应的化学方程式为 ,该反应的类型是取代反应;装置d的作用是吸收HBr和Br2,
,该反应的类型是取代反应;装置d的作用是吸收HBr和Br2,
故答案为:HBr;吸收HBr和Br2;
(2)②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2,
故答案为:除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是吸水(干燥),
故答案为:吸水(干燥);
(3)分液得到粗溴苯中还含有的主要杂质为苯,二者互溶,但沸点不同,要进一步提纯,应选择蒸馏操作,
故答案为:苯;C.(1)HBr;吸收HBr和Br2;
(4)15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴,可知烧瓶中液体体积19mL左右,液体体积不能超过a的容积的$\frac{1}{3}$,则选择50mL最适合,故答案为:B.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、有机物的性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意有机反应及混合物分离提纯的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
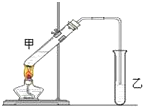 俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:
俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
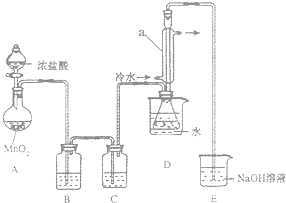 S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
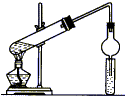 用如图所示装置制取乙酸乙酯,请回答以下问题.
用如图所示装置制取乙酸乙酯,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
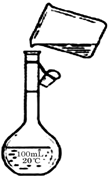 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用到的玻璃仪器有:玻璃棒、胶头滴管、500mL容量瓶、烧杯 | |
| B. | 需要称量氢氧化钠固体1.92g | |
| C. | 没有等溶液冷却就转移将导致所配溶液浓度偏高 | |
| D. | 洗净的容量瓶不需要干燥就能使用,但使用前需检漏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com