
【题目】水溶液中的离子平衡是中学学习的一个重要内容。请回答下列有关问题。
(1)常温下,用0.1000mol/L氨水滴定盐酸,当达到滴定终点时,溶液pH___7(填“>”、“<”或“=”),为了减小滴定误差,在滴定实验中使用的酸碱指示剂最好是___。(填字母)
A、甲基橙 B、酚酞 C、石蕊 D、以上均可
(2)常温下,将1 mL pH=12的NaOH溶液加水稀释到100mL,稀释后溶液中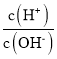 =___。
=___。
(3)某温度下,测得0.1 mol/LNaOH溶液pH为11,则该温度下水的离子积常数Kw=___。
(4)浓度相等的盐酸和醋酸各100mL,分别与过量的Zn反应,相同条件下生成H2的体积分别为V1和V2,则V1____V2(填“>”、“<”或“=”)
【答案】< A 10-6 10-12 =
【解析】
(1)常温下,用0.1000mol/L氨水滴定盐酸,当达到滴定终点时生成氯化铵,铵根离子水解溶液显酸性,当达到滴定终点时溶液的pH<7,溶液中各离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),指示剂变色范围为:酚酞8-10,甲基橙为3.1-4.4,石蕊为5-8,为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是甲基橙,故选A;
(2)1mLpH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中c(OH-)=1×10-4mol/L,c(H+)=1×10-10mol/L,则: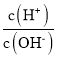 =1×10-6;
=1×10-6;
(3)某温度时,测得0.1molL-1的NaOH溶液的pH为11,该溶液中c(OH-)=0.1mol/L,c(H+)=![]() =10-11 mol/L,Kw=
=10-11 mol/L,Kw=![]() =0.1×10-11=10-12;
=0.1×10-11=10-12;
(4)浓度相等的盐酸和醋酸各100mL,HCl和醋酸的物质的量相等,分别与过量的Zn反应,生成氢气的体积相等,即V1=V2。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子式为C5H11Cl的同分异构体有7种
B. 分子中有两个—CH3,分子式为C5H11Cl的同分异构体有3种
C. 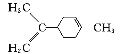 中所有碳原子一定在同一平面上
中所有碳原子一定在同一平面上
D. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺(NH2Cl,Cl的化合价为+1价)是一种长效缓释有机氯消毒剂,它与水可以发生复分解反应。有关氯胺的说法错误的是
A.氯胺中的氮元素为-3价
B.氯胺与水反应的产物为NH2OH和HCl
C.氯胺的消毒原理与漂粉精相似
D.氯胺的消毒效率(单位质量的消毒剂得到的电子数)是Cl2的1.38倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)不溶于水,与酸反应生成H2O2,在医学上可作解酸剂。常温下MgO2较稳定,加热时会分解生成O2和MgO。MgO与H2O2反应可制得MgO2,同时放出大量热。一种制备MgO2的流程如图所示:
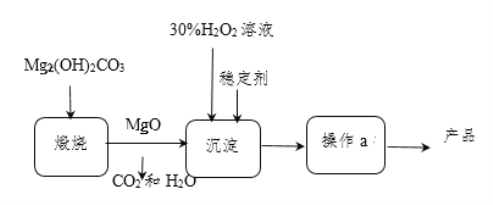
请回答下列问题:
(1)煅烧Mg2(OH)2CO3的化学反应方程式为_______________________;检验Mg2(OH)2CO3已分解完全的方法是______________________________。(写出实验操作和现象)
(2)上述制备过程中加入稳定剂的作用是___________;操作a为_____________。
MgO2产品中常会混有少量MgO,实验室可通过多种方案测定样品中MgO2的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中MgO2的含量。
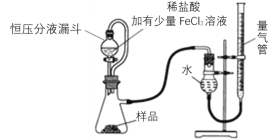
(3)研究小组的实验原理是(用化学方程式表示)①___________________________;
②2H2O2 → 2H2O +O2↑,稀盐酸中加入少量FeCl3溶液的作用是_______________。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、___________。
(5)反应结束后,先_________________,然后__________________,最后平视刻度线读数并记录。
(6)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为______(该实验条件下O2密度为ρ gL-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备合成氨原料气过程中存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol-1,下列判断正确的是
CO2(g)+H2(g) △H=-41kJ·mol-1,下列判断正确的是
A. 该反应的逆反应是放热反应B. 反应物总能量小于生成物总能量
C. 反应中生成22.4LH2(g),放出41kJ热量D. 反应中消耗1mol CO(g),放出41kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。


下列关于原电池和干电池的说法不正确的是
A. 两者正极材料不同
B. MnO2的放电产物可能是KMnO4
C. 两者负极反应式均为Zn失电子
D. 原电池中Zn与稀H2SO4存在自放电现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com