
【题目】下列物质中,有非极性共价键的是( )
A.氨
B.二氧化碳
C.过氧化钠
D.次氯酸
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学常见物质且均含有同一种元素,它们之间的部分转化关系如右图所示(反应条件及其他物质已经略去):![]() 。
。
(1)若A为淡黄色固体单质,且D为强酸
①B物质通常用________________(填试剂名称)来检验。
②从组成物质的元素化合价变化角度预测B可能具有的性质_______________ ,并用相应的化学方程式表示你预测的性质_________________________________________。
③一定条件下D转化为B有多种途径,写出其中一种D→B转化的化学方程式
______________________________________________________。
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出实验室制取A的化学方程式______________________________________。
②B、C都是大气污染物,它们对环境造成的危害表现在_______。
A 引起酸雨 B 引起温室效应 C形成光化学烟雾 D引起水体富营养化
③写出C→D转化的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各组物质的分类正确的是
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、Al2O3、SO3
④同位素:1H、2H2、3H
⑤同素异形体: C60、金刚石、石墨
⑥干冰、液氯等都是非电解质
A. ①②③④⑤⑥ B. ④⑥ C. ②⑤⑥ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 明矾净水原理是氢氧化铝胶粒能吸附水中杂质
B. 根据能否产生丁达尔效应将分散系分为胶体、溶液和浊液
C. 面粉厂、水泥厂“电泳除尘”是利用了胶体带电
D. 利用过滤操作可以提纯蛋白质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:C(s)+H2O(g)![]() CO(g)+H2 (g) ΔH>0, 某温度下,向5 L密闭容器中加入2 mol C(s)与1 mol H2O(g),t1 s时,CO的物质的量为0.20 mol,到第t2 s时恰好达到平衡,此时CO的物质的量为0.35 mol ,下列说法正确的是( )
CO(g)+H2 (g) ΔH>0, 某温度下,向5 L密闭容器中加入2 mol C(s)与1 mol H2O(g),t1 s时,CO的物质的量为0.20 mol,到第t2 s时恰好达到平衡,此时CO的物质的量为0.35 mol ,下列说法正确的是( )
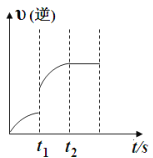
A. t1时改变的条件可能是使用催化剂
B.t1时改变的条件可能是增大 H2O 浓度
C.t1~t2这段时间内的化学反应速率 v(H2O)= 0.15/(t2-t1)
D.t2后继续加入 2 mol C(s)平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图
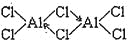
缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
(3)B原子的电子有 个不同的能级;晶体硼熔点为2300℃,则其为 晶体。
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
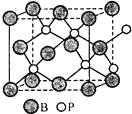
①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼 三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述,正确的是
A. 构成原电池的正极和负极必须是两种活泼性不同的金属
B. 原电池是将化学能转变为电能的装置
C. 在原电池中,电子流出的一极是负极,该电极被还原
D. 原电池放电时,电流的方向是从负极到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
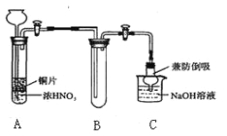
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的小木条迅速伸进试管内,发现木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的。为准确达到实验目的,需在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中反应产物的实验方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com