
| 1 |
| 2 |
| 3 |
| 2 |
| ||
| ||
| ||
| ||
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
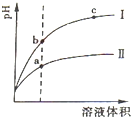 ��������0.1mol?L-1������ҺNaOH��NH3?H2O��HCl��CH3COOH
��������0.1mol?L-1������ҺNaOH��NH3?H2O��HCl��CH3COOH�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0��l mol/L�������Һ�У�c��Ca2+����c��CH3COO-����c��OH-����c��H+�� |
| B�������pH����ͬ��NH4Cl��Һ�����ᣬ��ȫ�ܽ������ҵ�������п�ۣ�ǰ������ʱ���� |
| C����n mol H2��g����n mol I2��g����2n mol H2 ��g����2n mol I2��g���ֱ�����������º��ݵ������У�ƽ��ʱH2��ת����ǰ��С�ں��� |
| D��ij���ʵ���Һ����ˮ�������c��H+��=1��10-a mol?L-1����a��7ʱ�������Һ��pHһ��Ϊ14-a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | Ki=1.77��10-4 | Ki=4.9��10-10 | Ki1=4.3��10-7 Ki2=5.6��10-11 |
| A��0.1 mol?L-lNaHCO3��Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c�� Na+����c��HCO3-��c��HJ-����c��OH-�� |
| B��������CO2ͨ�˵�NaCN��Һ�У�CN-+H2O+CO2�THCN+HCO3- |
| C����0.1 mol?L-l NaOH��Һ�к͵�Ũ�ȵ�HCN��Һ��HCOOH��Һʱ��ǰ������NaOH��Һ����� |
| D����ͬ�����0.1 mol?L-l HCOONa��Һ��0.1 mol?L-l NaCN��Һ������������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ȼ�̼ | B���������� |
| C���Ȼ��� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
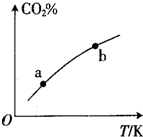 ��ij�����ܱ������г���һ����C02��H����������Ӧ��CO2��g��+H2��g��?HCOOH��g�����ƽ����ϵ��C02�İٷֺ�����CQ%���뷴Ӧ�¶ȱ仯�Ĺ�ϵ��ͼ��ʾ������������ �У�a�����b����� ������Ӧ���ʢ��淴Ӧ���ʢ�HCOOH��g����Ũ�Ȣܶ�Ӧ�¶�ʱ��ƽ�ⳣ����������
��ij�����ܱ������г���һ����C02��H����������Ӧ��CO2��g��+H2��g��?HCOOH��g�����ƽ����ϵ��C02�İٷֺ�����CQ%���뷴Ӧ�¶ȱ仯�Ĺ�ϵ��ͼ��ʾ������������ �У�a�����b����� ������Ӧ���ʢ��淴Ӧ���ʢ�HCOOH��g����Ũ�Ȣܶ�Ӧ�¶�ʱ��ƽ�ⳣ����������| A���٢� | B���٢� | C���ڢ� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
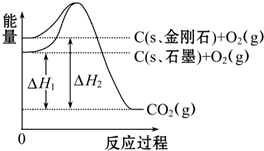
| A��C��s��ʯī���TC��s�����ʯ����H=+1.9 kJ?mol-1 |
| B��ʯī�ͽ��ʯ��ת���������仯 |
| C�����ʯ���ȶ���ǿ��ʯī |
| D��1 molʯī��������1 mol���ʯ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����
һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
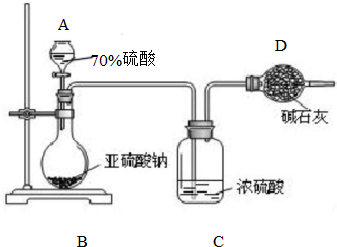 Ϊ�ⶨij����������Ʒ�Ĵ��ȣ���ͬѧ��ȡ10.0g���壬��������ʵ�飺
Ϊ�ⶨij����������Ʒ�Ĵ��ȣ���ͬѧ��ȡ10.0g���壬��������ʵ�飺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com