
| A.α1=α2>α3=α4 |
| B.α2=α4>α1=α3 |
| C.α1=α2=α3=α4 |
| D.α1=α3>α2=α4 |
 H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。
H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。

 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:不详 题型:单选题
| A.相等 | B.后者比前者大11倍 |
| C.后者是前者的108倍 | D.前者是后者的108倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.逐渐减小; | B.逐渐增大; | C.先逐渐增大,而后减小; | D.先逐渐减小,而后增大。你的选择是____(填正确选项的标号)。试用化学方程式和简要文字表达其理由。____________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是: c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 |
| C.0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
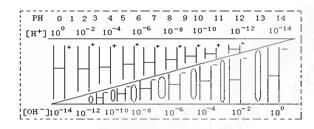

| A.该温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数 |
| B.若醋酸钠溶液中c(Na+)=c(CH3COO-),则溶液中的c(H+)=c(OH-) |
| C.如果定义pOH=-lg[c(OH-)]时,则该温度下某水溶液中的pOH和pH之和等于14 |
| D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com