
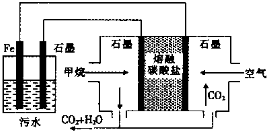
| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
分析 甲烷燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32--8e-═5CO2+2H2O,通入氧气的一极为原电池的正极,发生还原反应,电极方程式为O2+2CO2+4e-=2CO32-,铁连接原电池的正极,为电解池的阳极,被氧化,发生Fe-2e-=Fe2+,阴极生成2H++2e-=H2↑,亚铁离子与氢氧根离子结合生成氢氧化亚铁,又被氧化为氢氧化铁能净水,结合电子的转移和电极方程式解答该题.
解答 解:A.铁连接原电池的正极,为电解池的阳极,Fe失电子生成亚铁离子,亚铁离子与氢氧根离子结合生成氢氧化亚铁,又被氧化为氢氧化铁能净水,所以不能换成石墨电极,故A错误;
B.甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32--8e-═5CO2+2H2O,故B正确;
C.通入氧气的一极为原电池的正极,正极上氧气得电子发生还原反应,故C错误;
D.左侧装置中石墨电极中发生的反应为2H++2e-=H2↑,产生标准状况下气体44.8L气体,即2mol氢气,则转移电子为4mol,所以消耗的甲烷为0.5mol,故D错误.
故选B.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力的考查,题目难度不大,注意把握电极方程式的书写,为解答该题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
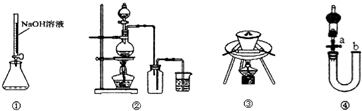
| A. | 用装置①量取15.00mL的NaOH溶液 | |
| B. | 用装置②制备并收集Cl2 | |
| C. | 用装置③陶瓷坩埚高温煅烧CaCO3固体 | |
| D. | 关闭活塞a,从b处加水,以检查装置④的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
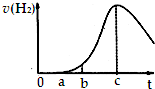 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O的原子个数之比一定为1:4:4 | |
| B. | 一定为烃类 | |
| C. | 分子中一定含有氧原子 | |
| D. | 分子式为CH4Ox(x=0、1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com