
ŌŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė4molµŖĘųŗĶ12molĒāĘų£¬Ź¹ĘäŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗN2(g)+3H2(g)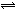 2NH3(g)£¬2minÄ©²āµĆNH3ĪŖ0.8mol£¬Ōņ£ŗ
2NH3(g)£¬2minÄ©²āµĆNH3ĪŖ0.8mol£¬Ōņ£ŗ
£Ø1£©ŅŌN2µÄÅØ¶Č±ä»Æ±ķŹ¾øĆ·“Ó¦ŌŚ2minÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ £»
£Ø2£©H2ŌŚ2minÄ©µÄĢå»ż·ÖŹżĪŖ £Ø±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©£»
£Ø3£©2minÄ©N2µÄ×Ŗ»ÆĀŹĪŖ £»
£Ø4£©ŅŃÖŖŌŚ25”ę£¬101kPaĻĀ£¬²šæŖ1mol N2ÖŠµÄ»Æѧ¼üŠčĻūŗÄ946kJµÄÄÜĮ棬²šæŖ1mol H2ÖŠµÄH”ŖH¼üŅŖĻūŗÄ436kJµÄÄÜĮ棬¶ųŠĪ³É1mol N”ŖH¼ü»į·Å³ö391kJµÄÄÜĮ攣ŹŌĶعżŅŌÉĻŹż¾Ż¼ĘĖćµ±·“Ó¦µō1molN2ŗĶ3molH2Éś³É2molNH3Ź±»į £ØĢī”°·Å³ö”±»ņ”°ĪüŹÕ”±£© ČČĮ棻
£Ø5£©Čō½«1mol N2ŗĶ3molH2ÖĆÓŚ¾ųČČĆܱÕČŻĘ÷ÖŠ£¬²¢ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦£¬·¢ĻÖČČĮæŹµ²āÖµ£Ø»Öø“µ½25”ę£¬101kPa£©Ō¶Š”ÓŚÉĻŹö¼ĘĖćÖµ£¬ÄćČĻĪŖ×īæÉÄܵÄŌŅņŹĒ ”£
£ØĆææÕ1·Ö£¬¹²6·Ö£¬ĪŽµ„Ī»»ņµ„Ī»Š““ķ²»µĆ·Ö£©
£Ø1£©0.1 mol/(L?min)
£Ø2£©71%
£Ø3£©10%
£Ø4£©·Å³ö £» 92kJ
£Ø5£©·“Ó¦N2+3H2 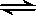 2NH3ŹĒæÉÄę·“Ó¦£¬1mol N2ŗĶ3molH2²»ÄÜĶźČ«×Ŗ»Æ³É2 molNH3”£
2NH3ŹĒæÉÄę·“Ó¦£¬1mol N2ŗĶ3molH2²»ÄÜĶźČ«×Ŗ»Æ³É2 molNH3”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ N2(g)+3H2(g)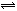 2NH3(g)
2NH3(g)
æŖŹ¼µÄĪļÖŹµÄĮæ 4mol 12mol 0mol
·“Ó¦µÄĪļÖŹµÄĮæ 0.4mol 1.2mol 0.8mol
2minÄ©ĪļÖŹµÄĮæ 3.6mol 10.8mol 0.8mol
£Ø1£©v(N2)=”÷c(N2)”Āt=”÷n(N2) ”ĀV”Āt=0.4mol”Ā2L”Ā2min=0.1mol/(L”¤min)
£Ø2£©H2ŌŚ2minÄ©µÄĢå»ż·ÖŹżĪŖ10.8mol”Ā(3.6mol+10.8mol+0.8mol)”Į100%=71%”£
£Ø3£©2minÄ©N2µÄ×Ŗ»ÆĀŹĪŖ0.4mol”Ā4mol”Į100%=10%”£
£Ø4£©”÷H=391kJ”Į2-946kJ+436kJ”Į3=-1472”£¹Źµ±·“Ó¦µō1molN2ŗĶ3molH2Éś³É2molNH3Ź±»į·Å³öČČĮ攣
£Ø5£©·“Ó¦ĪŖæÉÄę·“Ó¦£¬·“Ó¦Īļ²»ÄÜĶźČ«×Ŗ»ÆĪŖÉś³ÉĪļ”£
æ¼µć£ŗ»ÆŃ§Ę½ŗāµÄ¼ĘĖć ČČ»Æѧ·½³ĢŹ½ ·“Ó¦ĖŁĀŹµÄ¶ØĮæ±ķŹ¾·½·Ø »ÆŃ§Ę½ŗā½ØĮ¢µÄ¹ż³Ģ »ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ
µćĘĄ£ŗ±¾Ģā½ĻÄŃ£¬æ¼²é»ÆŃ§Ę½ŗāÖŠµČŠ§Ę½ŗāµÄ¼ĘĖć£¬Ć÷Č·ĪĀ¶ČÓėŃ¹Ēæ²»±äŹ±£¬ĘšŹ¼·“Ó¦ĪļµÄĮæ³ÉÕż±ČŌņĘ½ŗāµČŠ§ŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ||

| c2(NH3) |
| c(N2)”Įc3(H2) |
| c2(NH3) |
| c(N2)”Įc3(H2) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 2NH3£Øg£©+Q£ØQ£¾0£©£¬·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼£ŗ
2NH3£Øg£©+Q£ØQ£¾0£©£¬·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼£ŗ
| [NH3]2 |
| [N2]?[H2]3 |
| [NH3]2 |
| [N2]?[H2]3 |


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
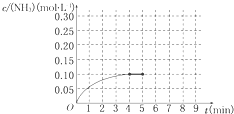 ŌŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÄŚĪŖ¼ÓČė 0.2molµÄN2ŗĶ0.6molµÄH2£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆµÄĒéæöČēĶ¼ĖłŹ¾£ŗ
ŌŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÄŚĪŖ¼ÓČė 0.2molµÄN2ŗĶ0.6molµÄH2£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆµÄĒéæöČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com