
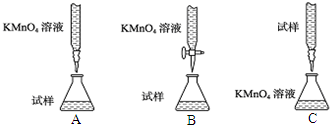
分析 (1)根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
(2)高锰酸钾具有强氧化性,能氧化碱式滴定管乳胶;滴定终点时,高锰酸钾稍过量,此时溶液出现浅红色半分钟不褪色;滴定发生的是氧化还原反应,稀释不影响滴定结果;
(3)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(4)根据物质的性质和书写离子方程式的有关要求书写离子方程式;
(5)根据离子方程式计算晶体中铁的质量分数;若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
解答 解:(1)在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
故答案为:溶解;定容;
(2)高锰酸钾具有强氧化性,能氧化碱式滴定管乳胶,故选用酸式滴定管盛放高锰酸钾溶液;滴定终点时,高锰酸钾稍过量,此时溶液出现浅红色半分钟不褪色;滴定发生的是氧化还原反应,稀释不影响滴定结果;
故答案为:B;碱式滴定管乳胶易被腐蚀;出现浅红色半分钟不褪色;无影响;
(3)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应;
故答案为:将Fe3+恰好还原成Fe2+;
(4)在步骤二中高锰酸钾氧化草酸跟生成CO2,的离子反应为:5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H+═2Mn2++8H2O+10CO2↑;在步骤三中高锰酸钾氧化Fe2+生成Fe3+,离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H+═2Mn2++8H2O+10CO2↑;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02mL+19.98mL}{2}$×0.01 mol•L-1×10-3×20=2.0×10-2mol,m(Fe)=56 g•mol-1×2.0×10-2mol=1.12g.晶体中铁的质量分数=$\frac{1.12g}{10g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高;
故答案为:11.2%;偏高.
点评 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 每摩尔Si晶体中,含有2摩尔Si-Si共价键 | |
| B. | 在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子 | |
| C. | 在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+ | |
| D. | 在金刚石晶体中,最小碳原子环含有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.
某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol碳正离子(CH3+)所含的电子总数为8NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有碳碳双键数为NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NN |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com