
设NA为阿伏加德罗常数的值,下列叙述正确的是( )。
A.标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16 g 14CH4所含中子数目为8NA
C.常温常压下,7.1 g Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
D.标准状况下,22.4 L空气含有NA个单质分子
科目:高中化学 来源:2014年高考化学题型冲刺练习 基础实验题(解析版) 题型:选择题
下列有关实验或操作的叙述正确的是( )
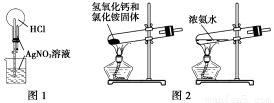
A.用图1所示的装置做喷泉实验时观察到产生白色喷泉
B.如图2所示的两套装置均可制备NH3(不考虑净化和收集)
C.称取2.5 g CuSO4·5H2O,放入100 mL容量瓶中,配制0.10 mol·L-1CuSO4溶液
D.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 化学基本概念、解决化学与STSE问题(解析版) 题型:选择题
化学无处不在,下列与化学有关的说法不正确的是( )
A.“神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中
四氧化二氮作氧化剂
B.废弃的金属、纸制品、塑料袋、玻璃都是可回收资源
C.2013年1月2日,印度金矿附近村庄出现砷中毒病例,砷中毒与环境污染有关
D.从2012年3月15日起,国家规定食用碘盐中碘含量为20~30 mg·kg-1,加碘盐中
的碘以碘化钾的形式存在
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
常温下,在下列各组溶液中,加水稀释时c(OH-)/c(H+)的值明显增大,且能大量共存的离子组是( )。
①K+、Al3+、NO3-、AlO2-
②K+、Fe2+、I-、SO42-
③K+、I-、NO3-、Na+
④Na+、Ca2+、Al3+、Cl-
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练4 无机化工流程题专项突破练习卷(解析版) 题型:填空题
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
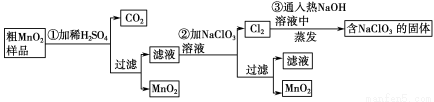
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是( )。
A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA
C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N—H键数目为0.6 NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法中正确的是( )。
A.等物质的量的CO2和NH3中所含的分子数均为NA
B.标准状况下,33.6 L SO3中含有的氧原子数是4.5NA
C.常温下,34.5 g NO2与N2O4的混合物中含有1.5NA个氧原子
D.电解精炼铜时,每转移2NA个电子,阳极溶解64 g铜
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA | NaOH | 混合溶液的pH |
甲 | [HA]=0.2 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=a |
乙 | [HA]=c1 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=7 |
丙 | [HA]=0.1 mol·L-1 | [NaOH]=0.1 mol·L-1 | pH=9 |
丁 | pH=2 | pH=12 | pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?________________________________________________
(2)c1________(填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是________(从下面选项中选择填空)。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是__________________________,其中,[A-]=________ mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA]________(填“<”、“>”或“=”)[NaOH],b________(填“<”、“>”或“=”)7。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:填空题
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是________和________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
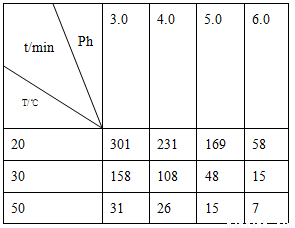
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0
c.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com