
| A. | 高铁酸钾处理水时,高铁酸钾发生还原反应 | |
| B. | 湿法中每生成1mol Na2FeO4共转移3mol电子 | |
| C. | 干法中每生成1mol Na2FeO4共转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
分析 A、化合价降低元素发生还原反应;
B、化合价升高数=化合价降低数=转移电子数;
C、化合价升高数=化合价降低数=转移电子数;
D、氧化剂能杀菌,Fe(OH)3(胶体)具有净水作用.
解答 解:A、高铁酸钾与水反应时,水中氧元素化合价升高,所以水发生氧化反应,Mn元素的化合价降低,所以高铁酸钾发生还原反应,故A正确;
B、反应2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中,化合价升高数=化合价降低数=转移电子数=6mol,生成了2molNa2FeO4,所以当生成1molNa2FeO4共转移3mol电子,故B正确;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=8mol,还有Na2O2中的氧由-1价升高到0价的O2,所以每生成1molNa2FeO4共转移电子应该为4+1=5mol,故C错误;
D、K2FeO4具有氧化性所以能杀菌,高铁酸钾与水反应时生成的Fe(OH)3(胶体)具有净水作用,故D正确.
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重计算能力、分析能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

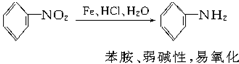


 ; B
; B ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱沾在皮肤上立即抹上稀硫酸 | |
| B. | “油锅”着火用锅盖或湿布盖灭 | |
| C. | 浓硫酸沾在皮肤上,先用干布或用纸吸干,再用大量清水冲洗 | |
| D. | 发生CO中毒时,首先采取开门、窗通风的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人的人体内体液pH总保持恒定 | |
| C. | 食物的酸碱性与化学上所指溶液的酸碱性不同的 | |
| D. | 蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌层破损后即对镀锌铁(白铁)制品失去保护作用 | |
| B. | 制备氢氧化铁胶体时,应向FeCl3溶液中滴加NaOH溶液,并继续煮沸至液体呈红褐色 | |
| C. | 用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘 | |
| D. | 用灼烧闻气味的方法可以区别棉花和羊毛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 6 | 8 | 10 |
| n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率ν(C)=0.02 mol•L-1•min-1 | |
| B. | 平衡后降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小 | |
| D. | 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
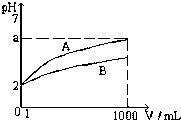 T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示
T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.2NA | |
| B. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| C. | 标准状况下,22.4 L汽油所含的分子数为NA | |
| D. | 在0℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为粗铜,Y为硫酸铜,K接N,则此装置可以精炼铜 | |
| B. | 若X为铜,Y为浓硝酸,K接M,可以形成原电池,则铁为负极 | |
| C. | 若X为锌,则无论K接M还是N,铁都能被保护 | |
| D. | 若X为银,Y为FeCl3,K接N,则此装置可以在铁上镀银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com