
| A、Fe2+→Fe3+ |
| B、H2SO4→SO2 |
| C、H2S→SO2 |
| D、HCO3-→CO2 |
科目:高中化学 来源: 题型:
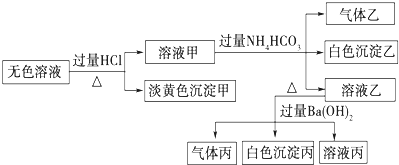

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42- |
| B、NO3- |
| C、SCN- |
| D、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过渡元素包括d、ds、f共三个区的元素,共中d区元素共包括六列六族 |
| B、在分子中碳原子形成双键,则该碳原子一定采取sp2杂化 |
| C、已知N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g),若该反应中有4 mol N-H键断裂,则形成的π键有2mol |
| D、植物光合作用所需的叶绿素是一种镁的配合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液中加入过量的锌粉:Zn+2Fe3+═Zn2++2Fe2+ | ||||
| B、NH4Al(SO4)2中加入过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O | ||||
| C、(CH3COO)2Ba中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
D、用惰性电极电解Cu(NO3)2溶液:2Cu2++2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①③④⑤ |
| C、②③④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4的摩尔质量是98 |
| B、H2SO4的摩尔质量与NA个H2SO4分子的质量相等 |
| C、等质量的O2和O3中所含氧原子数相同 |
| D、等物质的量的CO和CO2中所含碳原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com