
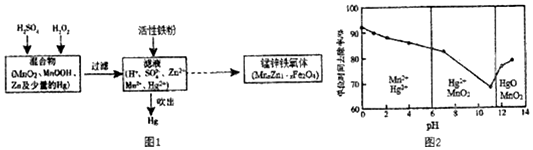
���� ��1��MnO��OH����Ũ���ᷴӦ��+4�۵����ܰ�Ũ��������Ϊ������
II����2���������չ��յ��ŵ�ӿɲ����ԡ���Ʒ�Ĵ��ȡ��Ի�����Ӱ��ȷ��������
��3����Na2CO3��Һ�л����μ�Mn2+��Һ����Ksp��֪��������Mn��OH��2��
III���Ժ��̻����Ϊԭ���Ʊ���п�����壬����MnO2��MnOOH��Zn������Hg�����������������������̺������⡢���ᷢ��������ԭ��Ӧ���������������̺�ˮ�����˳�ȥ���������ʣ���Һ�м������۳�ȥ���������Ĺ��ø��������Һ���ճ��������Һͨ��ʵ������õ���п�����壮
��4�����ݻ��ϼ۹����ж���Ԫ�صĻ��ϼۣ�
��5�������̿�֪�������۳���ʱ��Hg2+����ԭΪHg��
��6���������̱�˫��ˮ��ԭ��˵�������������������õ����ӣ�˫��ˮ�ǻ�ԭ��ʧȥ���ӣ�������������������
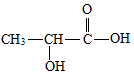
��7���ٸ������ͼ��֪pH=2ʱKMnO4��Һ���չ���������Mn2+��Hg2+��
�ڲ�����������������������ǿ���أ�������������Mn2+���ɣ�������Mn2+���д����ã�
��� �⣺��1��+4�۵����ܰ�Ũ��������Ϊ��������MnO��OH����Ũ���ᷴӦ�����������Ȼ��̡�ˮ���䷴Ӧ����ʽΪ��2MnO��OH��+6HCl $\frac{\underline{\;\;��\;\;}}{\;}$2MnCl2+Cl2��+4H2O��
�ʴ�Ϊ��2MnO��OH��+6HCl $\frac{\underline{\;\;��\;\;}}{\;}$2MnCl2+Cl2��+4H2O��
II����2���ӿɲ����ԡ���Ʒ�Ĵ��ȡ��Ի�����Ӱ��ȷ���������չ��յ��ŵ��֪���������̼�����CO2��H2O��Ӱ��MnSO4���ȣ���Ӧ�������ж��к�������
�ɣ�����ɶ�����Ⱦ��������Դ���ȣ�
�ʴ�Ϊ���������̼�����CO2��H2O��Ӱ��MnSO4���ȣ���Ӧ�������ж��к��������ɣ�����ɶ�����Ⱦ��������Դ���ȣ�
��3����Ksp��MnCO3��=2.3��10-11��Ksp[Mn��OH��2]=2.1��10-13��֪���� Na2CO3��Һ�л����μ�Mn2+��Һ��̼������Һ�ļ���ǿ����Ksp��֪��������Mn��OH��2������ѡ�õļ��Ϸ�ʽΪ����Na2CO3��Һ�������뵽ʢ��MnSO4��Һ�ķ�Ӧ�����У�̼������Һ�ļ���ǿ������������Mn��OH��2��
�ʴ�Ϊ��c������������Mn��OH��2��
III����4��MnxZn1-xFe2O4����Ԫ�ػ��ϼ�Ϊ-2��пΪ+2����Ԫ�ػ��ϼ�Ϊ+3�����ݻ��ϼ۴�����Ϊ0����֪��Ԫ�صĻ��ϼ�Ϊ+2�ۣ��������⣬
�ʴ�Ϊ��+3��+2��
��5��������֪�������۳���ʱ��Hg2+����ԭΪHg�����۵������ǻ�ԭ����
�ʴ�Ϊ����ԭ����
��6���������̱�˫��ˮ��ԭ��˵�������������������õ����ӣ�˫��ˮ�ǻ�ԭ��ʧȥ���ӣ���������������������Ӧ�Ļ�ѧ����ʽΪMnO2+H2O2 +2H+=Mn2++O2��+2H2O��
�ʴ�Ϊ��MnO2+H2O2 +2H+=Mn2++O2��+2H2O��
��7���ٸ������ͼ��֪pH=2ʱKMnO4��Һ���չ���������Mn2+��Hg2+����Ӧ�����ӷ���ʽΪ��5Hg+2MnO4-+16H+�T2Mn2++5Hg2++8H2O��
�ʴ�Ϊ��5Hg+2MnO4-+16H+�T2Mn2++5Hg2++8H2O��
����ǿ���Ի����й��ĵ�λʱ��ȥ���ʸߣ���ԭ���������Ũ������ʹKMnO4��Һ����������ǿ�⣬�����������ɵ�Mn2+�Է�Ӧ������ã���λʱ����ȥ���ʸߣ�
�ʴ�Ϊ��Mn2+�Է�Ӧ������ã���λʱ����ȥ���ʸߣ�
���� ���⿼���˹�ҵ�ϻ��ս����̵IJ������̣���Ҫ�����ʷ��뷽�����������ʵ�����Ӧ�ã�������ԭ��Ӧ�ķ����жϺͼ���Ӧ�ã���Ŀ�Ѷ��еȣ�ע���ͼ��ķ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�м�����������ʹ��ˮ���������ڽ����ˮ��ӦΣ�� | |
| B�� | �����ƹ�ũ�����������μ������Լ���ũҩ��ʹ�� | |
| C�� | ���ع��ͻ����ټӹ�Ϊʳ���ͣ��Լ���ˮ�帻Ӫ���� | |
| D�� | �þ�����ϩ����ľ�ģ�������װ�С���ͺеȣ��Լ���ľ�ĵ�ʹ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����������Ϲ��ϵ������л���֮һ����Ӧ�÷dz��㷺��������ʳƷ��ζ����ҽҩ����������ҵpH���ڼ��ȣ�����Ľṹ��ʽ��ͼ��ʾ��
�����������Ϲ��ϵ������л���֮һ����Ӧ�÷dz��㷺��������ʳƷ��ζ����ҽҩ����������ҵpH���ڼ��ȣ�����Ľṹ��ʽ��ͼ��ʾ��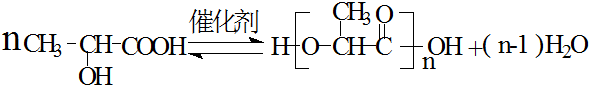 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+��OH-��Al3+��Cl- | B�� | K+��SO42-��HCO3-��Na+ | ||
| C�� | Mg2+��NO3-��Cl-��Na+ | D�� | MnO4-��K+��SO42-��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������þ�������OH-+H+�TH2O | |
| B�� | ͭƬ������������Һ�У�Cu+Ag+�TAg++Cu2+ | |
| C�� | ��ϡ�����������������Һ��H++OH-�TH2O | |
| D�� | ̼������Һ��ϡ�����ϣ�CO32-+2H+�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3���������� | B�� | ÿ����1molCO2��ת��2mol���� | ||
| C�� | Cl2�������� | D�� | C������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʱ������ӦʽΪ��Zn-2e-+2OH-=Zn��OH��2 | |
| B�� | 0.1molK2FeO4������Ӧ��ת�Ƶ�����ԼΪ1.806��1024 | |
| C�� | ���ʱK2FeO4����������Ӧ | |
| D�� | �ŵ�ʱ������ӦΪ��2FeO42-+6e-+8H2O=2Fe��OH��3+10OH- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com