
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
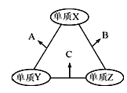
A.X元素位于ⅥA
B.A和C不可能发生氧化还原反应
C.B的沸点高于C的沸点
D.A不能溶解于B中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是
A. 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色
B. 将葡萄糖溶液加入新制Cu(OH)2悬浊液至沸腾,出现红色沉淀
C. 将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫红色褪去
D. 将SO2滴入盛有酚酞的NaOH溶液中,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲苯与浓硫酸、浓硝酸在100℃时能获得不溶于水的淡黄色针状晶体,请写出反应方程式:__________。上述反应是加成反应还是取代反应?请判断并说明原因:__________________。
(2)Mg3N2是离子化合物,各原子均满足8电子稳定结构,写出Mg3N2的电子式:__________。
(3)在常压下,乙醇在水中的溶解度比溴乙烷在水中的溶解度大,主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g)△H<0
①该反应中,反应物总能量_______(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为________mol。
③该反应中,还原剂为_______(填化学式),氧化产物与还原产物的质量比为_______。
(2)也可以利用甲烷催化还原氮氧化物,已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol ;CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_______。
(3)锌锰干电池是应用最普遍的电池之一(如图所示),总反应方程式为: Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O
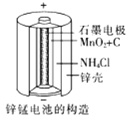
①锌锰干电池的负极材料是________,
②负极发生的电极反应方程式为:_______
③正极发生的电极反应方程式为:________。
④若反应消耗32.5 g负极材料,则电池中转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液a逐滴加入固体b中,下列叙述中不正确的是( )
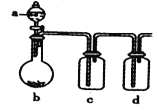
A.若a为浓硫酸,b为Na2SO3固体,c盛石蕊溶液,则c溶液先变红后褪色
B.若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色
C.若a为醋酸溶液,b为碳酸钙,c中盛过量澄清石灰水,则c中溶液变浑浊
D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PBAT(聚已二酸/对苯二甲酸丁二酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物 PBA 和PBT 共聚制得,一种合成路线如下:
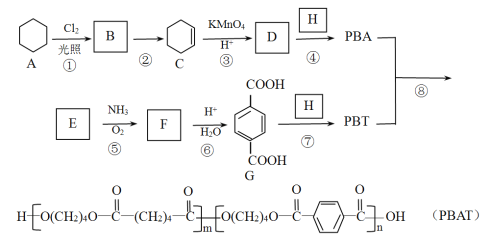
已知:R-CH3![]() R-CN
R-CN![]() R-COOH
R-COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)B 的官能团名称为_____,D 的分子式为_____。
(2)①的反应类型为_____;反应②所需的试剂和条件是_____。
(3)H 的结构简式为_____。
(4)⑤的化学方程式为_____。
(5)M 与G 互为同系物,M 的相对分子质量比G 大 14;N 是 M 的同分异构体,写出同时满足以下条件的N 的结构简式:______________(写两种,不考虑立体异构)。
Ⅰ.既能与 FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ.与 NaOH 溶液反应时,1mol N 能消耗 4molNaOH;
Ⅲ.核磁共振氢谱有五组峰,峰面积比为 1:2:2:2:1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,下面表示的反应速率最快的是
A.v(A)=0.5mo1/(L·s)B.v(B)=1.8mo1/(L·min)
C.v(C)=0.9mo1/(L·s)D.v(D)=1.0mo1/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2 和 LiMnO2 等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态 Ti 原子的价层电子排布图为____。
(2)在第四周期 d 区元素中,与 Ti 原子未成对电子数相同的元素名称________。
(3)金属钛的原子堆积方式如图所示,则金属钛晶胞俯视图为______。
![]()
(4)已知第三电离能数据:I3(Mn)=3246 kJ·mol-1,I3(Fe)=2957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是______。
(5)据报道,在 MnO2 的催化下,甲醛可被氧化成 CO2,在处理含 HCHO 的废水或空气方面有广泛应用。HCHO中键角________CO2 中键角(填“大于”“小于”或“等于”)。
(6)Co3+、Co2+能与 NH3、H2O、SCN-等配体组成配合物。
①1 mol[ Co(NH3)6]3+含______mol σ键。
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式为[S=C=N] -,SCN-与金属离子形成的配离子中配位原子是_______(填元素符号)。
(7)工业上,采用电解熔融氯化锂制备锂,钠还原 TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为 605℃、-24℃,它们的熔点相差很大,其主要原因是________。
(8)钛的化合物晶胞如图所示。

二氧化钛晶胞如图 1 所示,钛原子配位数为______。氮化钛的晶胞如图 2 所示, 图 3 是氮化钛的晶胞截面图(相邻原子两两相切)。已知:NA 是阿伏加德罗常数的值,氮化钛晶体密度为 d g·cm-3。氮化钛晶胞中 N 原子半径为________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com