
【题目】常温下将0.1mol下列物质分别投入90g水中充分混合:①Na②NaOH③Na2O④Na2O2,所得溶液中OH-物质的量浓度大小排列顺序正确的是( )
A.③>④>②>①B.④>③>②>①
C.①>④=③>②D.③=④>①>②
【答案】D
【解析】
氢氧化钠的质量分数越大,氢氧化钠的浓度越大,氢氧化钠的物质的量浓度也越大。①发生反应:2Na+2H2O=2NaOH+H2↑,②NaOH溶于水,0.1molNa与NaOH溶于水,溶于水中NaOH的物质的量都是0.1mol,而Na与水反应生成氢气,故Na与水反应所得溶液的质量小于NaOH溶于水形成的溶液质量,氢氧化钠的质量分数②<①,故OH-物质的量浓度②<①;③发生反应:Na2O+H2O=2NaOH,④发生反应:2Na2O2+2H2O=4NaOH+O2↑,可知0.1mol的氧化钠、过氧化钠溶于水,溶液中NaOH都是0.2mol,由差量法可知,④中过氧化钠溶于水相当于氧化钠溶于水,二者所得溶液质量相等,二者氢氧化钠的质量分数相等,溶液中OH-物质的量浓度③=④;③所得NaOH为①中的2倍,而③所得溶液质量=100g+0.1mol×62g/mol=106.2g,由方程式可知,①中生成氢气的物质的量=0.1mol×![]() =0.05mol,①中所得溶液的质量=100g+0.1mol×23g/mol-0.05mol×2g/mol=102.2g,故③所得溶液质量小于①所得溶液的2倍,氢氧化钠的质量分数①<③,故OH-物质的量浓度①<③;故溶液中OH-物质的量浓度③=④>①>②,故选D。
=0.05mol,①中所得溶液的质量=100g+0.1mol×23g/mol-0.05mol×2g/mol=102.2g,故③所得溶液质量小于①所得溶液的2倍,氢氧化钠的质量分数①<③,故OH-物质的量浓度①<③;故溶液中OH-物质的量浓度③=④>①>②,故选D。


科目:高中化学 来源: 题型:
【题目】丙烯酰胺(H2C=CH—CONH2)具有中等毒性,它对人体可造成神经毒性和遗传毒性。丙烯酰胺主要是由高碳水化合物、低蛋白质的植物性食物在加热(120℃以上)烹调过程中形成,特别在烘烤、油炸时更易形成。丙烯酰胺可以进一步形成在工业上有用的聚丙烯酰胺类物质。

回答下列问题:
(1)D的结构简式为___,F的结构简式为___。
(2)指明下列反应类型:A→B___,C→D___。
(3)丙烯酰胺有多种同分异构体,写出分子中同时含有醛基和碳碳双键的同分异构体:___。
(4)写出D→E的化学方程式:__。2分子C在浓硫酸作用下可形成一个六元酯环,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是______,C含有的官能团名称是______。
(2)反应![]() 的反应类型是______。
的反应类型是______。
(3)反应![]() 的化学方程式为______。
的化学方程式为______。
(4)反应③~⑤中引入![]() 的作用是______。
的作用是______。
(5)满足下列条件的C的同分异构体共有______种![]() 不含立体异构
不含立体异构![]() 。
。
![]() 能使
能使![]() 溶液显紫色;能与NaHCO3发生反应。
溶液显紫色;能与NaHCO3发生反应。![]() 苯环上有两个取代基。
苯环上有两个取代基。
其中核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:2:2:1,该有机物的结构简式是______。
(6)参照上述合成路线,以![]() 为原料,设计制备
为原料,设计制备 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四瓶盛有相同物质的量的NaOH溶液中通入体积不同的CO2气体后,得到①②③④四瓶溶液。分别向四瓶溶液中逐滴加入等浓度的盐酸,产生的气体体积V(CO2)与所加盐酸体积V(HCl)的关系如下图所示,且图②③④中分别有OA<AB、OA=AB、OA>AB,则下列分析与判断正确的是(忽略CO2的溶解)

A. ①中通入的CO2最少 B. ③中的溶质只有Na2CO3
C. 有两种溶质的是②和③ D. 若④中OA>2AB,则有c(NaHCO3)<c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图。下列有关说法中正确的是( )

A.y轴表示的可能是电离能B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径D.y轴表示的可能是形成基态离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述,正确的是
A.若2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则1mol碳完全燃烧放出的热量大于110.5kJ
B.若CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-812.3kJ/mol,则甲烷的燃烧热为812.3kJ/mol
C.若2NO2(g)![]() N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
D.若H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,含1 mol CH3COOH的溶液与含1molNaOH的溶液混合,放出热量为57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:
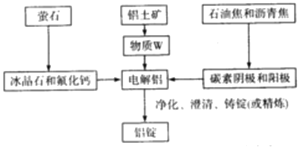
该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为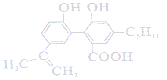 ,下列说法正确的是( )
,下列说法正确的是( )
A. 1 mol该有机物最多可以与7 mol H2发生加成反应
B. 该有机物可以发生取代、加成、氧化、水解等反应
C. 0.1 mol该有机物与足量金属钠反应最多可以生成3.36L H2
D. 与该有机物具有相同官能团的同分异构体共有8种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com