
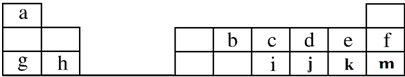
 ��Ԫ��d��Ԫ��g�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽΪ
��Ԫ��d��Ԫ��g�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽΪ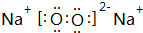 ������Ԫ�ط�����գ�
������Ԫ�ط�����գ����� ��Ԫ�������ڱ���λ�ã���֪aΪH��bΪC��cΪN��dΪO��eΪF��fΪNe��gΪNa��hΪMg��iΪP��jΪS��kΪCl��mΪAr��
��1��jΪ��Ԫ�أ�
��2��Ԫ��e�ĸ�һ������ΪF-��Ԫ��d��Ԫ��g�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2��
��3��������������ԭ�Ӿ��壻
��4���ǽ�����Խǿ���⻯��Խ�ȶ���
��5��ͬ����������ҽ����Լ��������Ը��ݽ���������ˮ���ᷴӦ���׳̶ȡ����ҳ̶ȣ����߸�������������Ӧˮ����ļ���ǿ�����жϣ�
��� �⣺��Ԫ�������ڱ���λ�ã���֪aΪH��bΪC��cΪN��dΪO��eΪF��fΪNe��gΪNa��hΪMg��iΪP��jΪS��kΪCl��mΪAr��
��1��jΪ��Ԫ�أ��ʴ�Ϊ����
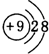
��2��Ԫ��e�ĸ�һ������ΪF-�����ӽṹʾ��ͼΪ ��Ԫ��d��Ԫ��g�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2������ʽΪ
��Ԫ��d��Ԫ��g�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2������ʽΪ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��3��������̼���ڷ��Ӿ��壬������������ԭ�Ӿ��壬
�ʴ�Ϊ��Si��
��4��ͬ����������ҷǽ����Լ������ǽ�����Cl��Si���ǽ�����Խǿ���⻯��Խ�ȶ�����HCl���ȶ���
�ʴ�Ϊ��HCl��
��5��ͬ����������ҽ����Լ�������Na�Ľ����Ա�Mg��ǿ�����Ը��ݽ���������ˮ���ᷴӦ���׳̶ȡ����ҳ̶ȣ����߸�������������Ӧˮ����ļ���ǿ�����жϣ�
�ʴ�Ϊ��Na��cd��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã�ע���Ԫ�������ɱ��������գ�����Ԫ�������ɣ�ע�����ս����ԡ��ǽ�����ǿ���Ƚ�ʵ����ʵ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������2 | B�� | ��������2 | C�� | ��������3 | D�� | ��������1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO��ȼ����Ϊ-283 kJ/mol | |
| B�� | �ڢ۷�Ӧʱ�����������������ʹ��H��С | |
| C�� | ��Ͷ��1molCO2��3molH2��һ�������³�ַ�Ӧ����ų�����49 kJ | |
| D�� | ��������ͬ������CO2����ų�������C2H2����CO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �ۢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ�����ԣ������еμ�������ɫʯ����Һ���������Һ��� | |
| B�� | ֻ���ڹ��ۼ�������һ���ǹ��ۻ�̨����ӻ�������һ���������Ӽ� | |
| C�� | Na2O��Na2O2���Ԫ����ͬ���������Ӹ�������ͬ������ˮ��Ӧ�IJ��ﲻͬ | |
| D�� | Ԫ��ԭ�ӵ�����������Խ�࣬�õ�������Խǿ��ʧ��������Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1 CH3COONa��Һ��0.1 mol•L-1HCl��Һ�������ϣ�c��Na+��=c��Cl-����c��CH3COO-����c��OH-�� | |
| B�� | 0.1 mol•L-1 NH4Cl��Һ��0.1 mol•L-1��ˮ�������ϣ�pH��7����c��NH3•H2O����c��NH4+����c��Cl-����c��OH-�� | |
| C�� | 0.1 mol•L-1Na2CO3��Һ��0.1 mol•L-1NaHCO3��Һ�������ϣ�$\frac{3}{2}$c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| D�� | 0.1 mol•L-1Na2C2O4��Һ��0.1 mol•L-1HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c��C2O42-��+c��HC2O42-��+c��OH-��=c��Na+��+c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����SO2ͨ��Ca��ClO��2��Һ�У�SO2+H2O+Ca2++2ClO-�TCaSO3��+2HClO | |
| B�� | ��ϡ��ˮ��ͨ������CO2��2NH3•H2O+CO2�T2NH4++CO32-+H2O | |
| C�� | ��ϡHCl��Һ�ܽ�FeS���壺FeS+2H+�TFe2++H2S�� | |
| D�� | Cl2��ˮ��Ӧ��Cl2+H2O�THCl+HClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
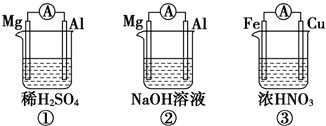
| A�� | �٢���Mg������������Fe������ | |
| B�� | ����Al����������缫��ӦʽΪAl-3e-=Al3+ | |
| C�� | ����Fe���������缫��ӦʽΪFe-2e-=Fe2+ | |
| D�� | ���٢���ת�Ƶĵ�������ͬ����٢��в�����H2����Ҳһ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com