
分析 锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L-0.05mol=1.8mol,根据反应的化学方程式计算.
解答 解:n(H2SO4)浓=0.1L×18.5mol/L=1.85mol,
剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=1.85mol-0.05mol=1.8mol,
锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,
生成气体为SO2和H2的混合物,物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,
设混合物气体中含有xmolSO2,ymolH2,
Zn+2H2SO4=ZnSO4+SO2↑+H2O
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑
ymol ymol
则:$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=1.8}\end{array}\right.$
解得:$\left\{\begin{array}{l}{x=0.3}\\{y=1.2}\end{array}\right.$
则气体A中n(SO2):n(H2)=x:y=0.3:1.2=1:4,
所以V(SO2):V(H2)=(0.3×224):(1.2×22.4)=1:4
答:气体A中各组分的体积比V(SO2):V(H2)=1:4.
点评 本题考查化学方程式的计算,题目难度中等,本题注意以下几点:①浓硫酸与锌反应生成SO2,②随着反应的进行,硫酸的浓度降低,与锌反应生成H2,③根据反应的方程式利用守恒的方法列式计算.


科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、SO42-、Cl- | B. | Na+、K+、CO32-、SO42- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
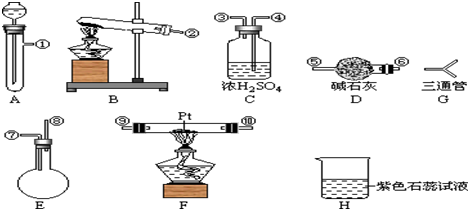
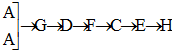 [按装置先后顺序排列]
[按装置先后顺序排列]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云示意图中的小黑点表示原子核最外层的电子 | |
| B. | 某元素有多种同位素,天然存在的该元素其中一种同位素的丰度为75%,则100 g天然存在的该元素中,此同位素的质量为75 g | |
| C. | 核外电子的运动状态是由该电子的电子层、电子亚层、电子云的伸展方向和电子自旋方向共同决定的 | |
| D. | 电子离核越远能量越高,所以N层电子的能量一定高于M层电子的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 | |
| B. | 非极性键可以存在于离子化合物中; 质子数相同的粒子不一定属于同种元素 | |
| C. | 同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应可能需要加热才可以发生 | |
| C. | 反应条件是加热的反应都是吸热反应 | |
| D. | 化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于相同pH的弱酸HX和HY(前者的Ka较小),加水稀释后pH值仍相同,则前者酸中稀释的倍数更大 | |
| B. | 在CH3COOH和CH3COONa浓度均为0.1mol/L的体系中,外加少量强碱时,溶液的PH值发生较大变化 | |
| C. | 在Na2HPO4水溶液中存在关系式:c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)═c(Na+) | |
| D. | 沉淀溶解平衡BaSO4═Ba2++SO42- 的沉淀溶解平衡常数为1.1×10-10,说明难溶盐BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)═0.2 mol•L-1 | |
| B. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.2 mol•L-1 HCl溶液与等体积0.1 mol•L-1 NaOH溶液混合后,溶液的pH=1 | |
| D. | 0.1 mol•L-1氨水中滴入0.1 mol•L-1盐酸至溶液呈中性时:c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃 | B. | 闻气味 | ||
| C. | 湿润的淀粉碘化钾试纸 | D. | 干燥pH试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com