
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
分析 根据影响化学平衡移动的因素:升高温度、平衡向着吸热方向移动,降低温度,平衡向着放热方向移动;升高压强,平衡向着气体体积减小的方向移动,降低压强,平衡向气体体积增大的方向移动;增大反应物浓度或者减小生成物浓度平衡都向正方向移动;催化剂只改变反应速率不改变平衡移动.
解答 解:X(s)+3Y(g)═2Z(g)(正反应是放热反应),因为X为固体,所以增加X平衡不移动,故①错误;
该是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故②正确;
增大压强,平衡向着气体体积减小的方向即正向进行,减小压强,平衡逆向移动,故③正确;④错误;
加催化剂不会引起化学平衡的移动,故⑤错误;
分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确.
故选B.
点评 本题考查学生化学平衡移动原理知识,可以根据所学知识来回答,难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
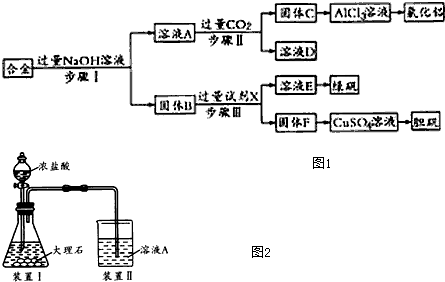
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ) 4种有机物分别在一定条件下与H2充分反应.
) 4种有机物分别在一定条件下与H2充分反应. 滴入溴水后,反应生成产物的结构简式为
滴入溴水后,反应生成产物的结构简式为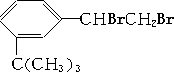 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如图,它可能发生的反应类型有:①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚( )
某有机物的结构简式如图,它可能发生的反应类型有:①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚( )| A. | ①②③⑥⑧ | B. | ②③④⑤⑧ | C. | ①②③⑤⑥⑦ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O (l)+CaO(s)═Ca(OH)2(s) | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O | |
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | |
| D. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO与O2反应生成NO2 | B. | NH3经催化氧化生成NO | ||
| C. | 由NH3制碳铵和硫铵 | D. | N2与H2在一定条件下合成氨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com