



 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
【化学一选修2化学与技术】(15分)
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下:
请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
查看答案和解析>>
科目:高中化学 来源:2012届河北省冀州市中学高三联排考试化学试卷(带解析) 题型:填空题
【化学一选修2化学与技术】(15分)
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下: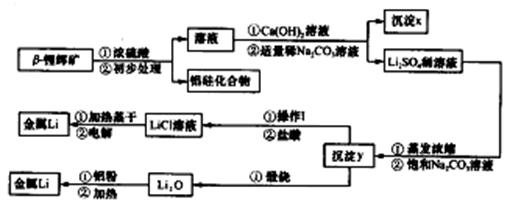
请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
查看答案和解析>>
科目:高中化学 来源:2012届河北省石家庄市高三第二次模拟理科综合化学试卷(带解析) 题型:填空题
[化学一选修2:化学与技术](15分)已知:
①工业上用硫酸与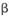 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图: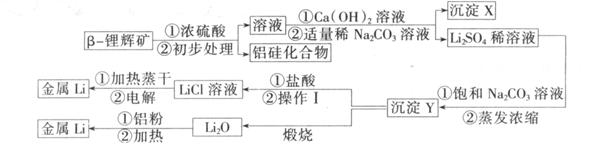
请回答:
(1)沉淀Y的主要成分的化学式是____________。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其使用的原因____________
(3 )操作1涉及的实验方法是__________________。
(4 )写出用铝粉还原法制取金属锂的化学反应方程式。________________________
(5) LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是__________________
(6) 目前电池通常使用金属锂的优点是__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com