

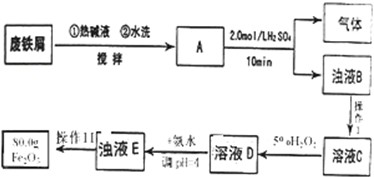
分析 (1)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,依据氧化还原反应电子守恒和 原子守恒配平;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(3)a、生成碳酸钠的反应是二氧化碳和过氧化钠发生的反应,生成碳酸钠和氧气;
b、为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气;
解答 解:(1)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:溶液变蓝,铜片溶解,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(3)a、生成碳酸钠的反应是二氧化碳和过氧化钠发生的反应,反应的化学方程式为:2CO2+2Na2O2═2Na2CO3+O2,通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,一氧化氮是污染性气体,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
故答案为:2CO2+2Na2O2═2Na2CO3+O2;碱石灰;
b.为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气,
故答案为:打开弹簧夹,通入N2一段时间.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | W的氢化物比X的氢化物的稳定性高 | |
| C. | Y元素比W元素的非金属性强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com