
下列物质及用途对应不正确的是
| A | B | C | D |
物质名称 | 氢氧化铝 | 碳酸钠 | 氢氧化钠 | 油脂 |
用途 | 做抗酸药 | 去除油污 | 做调味剂 | 制造肥皂 |
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
常温时,下列各溶液中,离子的物质的量浓度关系正确的是
A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
B.pH=2的醋酸中:c(H+)=0.02mol?L-1
C.0.1 mol?L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+)
D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:实验题
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
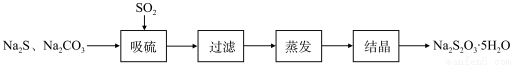
(1)吸硫装置如图所示。
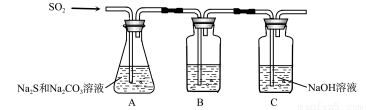
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 (填“无影响”、“偏低”或“偏高”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
下列判断错误的是:( )
A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42?+H++OH? =BaSO4↓+H2O
B.常温下,等物质的量浓度的三种溶液①(NH4)2CO3;②NH4Cl;③(NH4)2Fe(SO4)2中c(NH4+):①<②<③
C.加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I- 四种离子不能大量共存
D.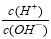 =1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存
=1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、除杂及收集装置如图所示。仅用此装置和表中提供的物质完成相关实验,最合理的是
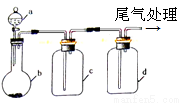
选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
A | 浓氨水 | CaO | 浓H2SO4 | NH3 |
B | 浓硫酸 | Na2SO3 | 浓H2SO4 | SO2 |
C | 饱和食盐水 | 电石 | CuSO4溶液 | CH≡CH |
D | 浓盐酸 | MnO2 | 饱和NaCl溶液 | Cl2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
有关下列图象的说法正确的是
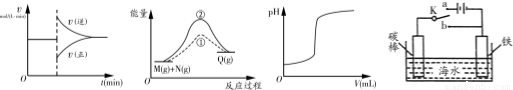
甲 乙 丙 丁
A.图甲中的曲线可以表示某化学平衡体系改变温度后反应速率随时间的变化
B.图乙中①、②曲线分别表示反应M(g)+N(g)→Q(g) ΔH >0使用和未使用催化剂时,反应过程中的能量变化
C.图丙中的曲线可表示向一定量的氢氧化钠溶液中滴加一定浓度盐酸时的pH变化
D.图丁中开关K置于a或b处均可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
某化学小组用下图装置电解CuCl2溶液制少量漂白液:
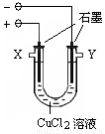
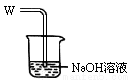
(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有 、或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,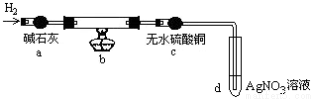
进行实验。实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是 ,无水硫酸铜的作用是 ;
②d中反应的离子方程式是 ;
③装置b中发生反应的化学方程式是 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为 。
⑤阴极上产生白色物质的物质的量是 ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会 (偏大、偏小、不变)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
实验:① 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。② 向沉淀c中滴加0.1mol/L FeCl3溶液,沉淀变为红褐色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
B.滤液b中不含有Mg2+
C.②中颜色变化说明Mg (OH)2转化为Fe(OH)3
D.实验可以证明Fe(OH)3比Mg (OH)2更难溶
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
将气体A2和B2以等物质的量充入密闭容器,一定条件下发生反应生成C气体。平衡时测得c(A2)= 0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则C的分子式为
A.AB B.AB2 C.A2B D.A2B3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com