

| A. | a、b两点溶液中水的电离程度相同 | |
| B. | a、b两点溶液的pH满足:pH(a)>pH(b) | |
| C. | c点溶液满足:c(Na+)>c(CO3 2-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO3 2-)+c(OH-) |
分析 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系如图,开始反应为CO2+2OH-=CO32-+H2O,碳酸根离子物质的量增大,当全部生成碳酸根离子后继续通入二氧化碳气体,发生反应CO2+CO32-+H2O=2HCO3-,a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,
A.b点碳酸氢钠、碳酸钠的混合物,二者水解促进水的电离,a点氢氧化钠抑制水的电离,碳酸钠促进水的电离;
B.a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,据此比较pH大小;
C.c点得到的溶液是碳酸钠溶液,根据碳酸根子水解结合离子浓度之间的关系来回答;
D.溶液中存在电荷守恒,阴阳离子所带电荷总数相同.
解答 解:向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系如图,开始反应为CO2+2OH-=CO32-+H2O,碳酸根离子物质的量增大,当全部生成碳酸根离子后继续通入二氧化碳气体,发生反应CO2+CO32-+H2O=2HCO3-,a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,
A、b点碳酸氢钠、碳酸钠的混合物,二者水解促进水的电离,a点氢氧化钠抑制水的电离,碳酸钠促进水的电离,所以b点水的电离程度大,故A错误;
B、a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,溶液的pH满足:pH(a)>pH(b),故B正确;
C、c点得到的溶液是碳酸钠溶液,碳酸根子水解溶液显示碱性,溶液中满足:c(Na+)>c(CO3 2-)>c(OH-)>c(HCO3-)>c(H+),故C正确;
D、a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,c点得到的溶液是碳酸钠溶液,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HCO3-)+2c(CO3 2-)+c(OH-),故D正确;
故选A.
点评 本题考查了电解质溶液中盐类水解原理、电荷守恒、物料守恒、质子守恒等离子浓度关系的分析判断,主要是反应过程中生成产物的分析,图象变化特征是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
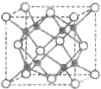 元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:
元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
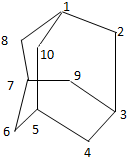 有的油田开采的石油中溶有一种碳氢化合物-金刚烷.
有的油田开采的石油中溶有一种碳氢化合物-金刚烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同一个电子层上运动的电子,其自旋方向肯定不同 | |
| B. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 | |
| C. | 物质的键能越大,该物质本身具有的能量越低 | |
| D. | 在周期表中原子的族序数等于它的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
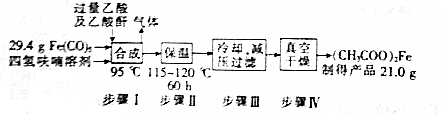
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 13种 | C. | 14种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
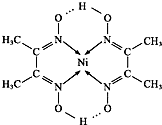
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com