
分析 依据三价铁离子、铜离子、二价铁离子的氧化性强弱判断反应先后顺序,若充分反应后,铁粉有剩余,则三价铁离子、铜离子一定完全反应;
若反应后,有铜生成,铁粉无剩余,则一定无三价铁离子存在,一定存在亚铁离子,可能含有铜离子,据此解答.
解答 解:三价铁离子、铜离子、二价铁离子的氧化性依次减弱,加入铁粉,先与三价铁离子反应,再与铜离子反应,
(1)当铁粉有剩余时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe═3FeCl2、CuCl2+Fe═Cu+FeCl2,溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;固体为Fe Cu;反应后溶液中的溶质为氯化亚铁,根据氯离子守恒:n(Cl-)=(1mol/L×3+1mol/L×2+1mol/L×2)×0.1L=0.7mol,所以n(Fe2+)=$\frac{1}{2}$n(Cl-)=0.35mol;
故答案为:Fe2+;0.35;Fe、Cu;
(2)当有铜生成,铁粉无剩余,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;
如果只有Fe2+,则其物质的量为:0.35mol,如果还有Cu2+,且最多为0.1mol时,只发生2FeCl3+Fe=3FeCl2,则Fe2+物质的量为0.25mol,由于两个反应都发生,所以Cu2+小于0.1mol,因此Fe2+物质的量大于0.25mol,故Fe2+物质的量为:0.25mol<n(Fe2+)≤0.35mol;
故答案为:Fe2+;0.25mol<n(Fe2+)≤0.35mol.
点评 本题考查了Fe与Fe3+、Cu2+的反应,熟悉三价铁离子、铜离子氧化性强弱是解题关键,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁屑与足量稀硝酸反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+═2Fe2++S↓ | |
| D. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O═CH3COO-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
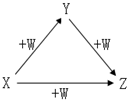 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
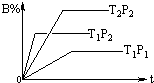 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>P△H<0 | B. | T1>T2 P1<P2 m+n<P△H>0 | ||
| C. | T1<T2 P1<P2 m+n<P△H<0 | D. | T1>T2 P1<P2 m+n>P△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com