
【题目】在一化学反应中,其产物的总能量为60kJ,如果该反应是放热反应,那么反应物的总能量可能是 ( )
A.80kJB.50kJC.30kJD.20kJ
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,求:
(1)该浓硝酸中HNO3的物质的量浓度?
(2)该合金中铜与镁的物质的量之比?
(3)NO2和N2O4的混合气体中,它们的体积分数分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14 分) 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

①A 点时剩余固体的成分是 (填化学式)。B 点时剩余固体的成分是 (填化学式)
②从开始加热到 750K时总反应方程式为 。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 利用Cu与FeCl3溶液的反应制作印刷电路板
B. 燃着的镁条可以在二氧化碳气体中继续燃烧
C. 灼热的铜丝放入盛有干燥氯气的集气瓶中燃烧生成蓝色的烟雾
D. 钠能从钛、锆等金属的氯化物中置换出金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10.0mL 下列气态有机物在 50.0mL O2中充分燃烧后,将生成的气体混合物通过足量浓硫酸,剩余35.0mL 的气体混合物(反应前后压强相等),则该有机物可能是
A. C3H8OB. C2H6O2
C. C4H10O2D. C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是水煤气中的CO和H2按物质的量之比1∶2反应生成的惟一产物,F是由两种均具有芳香气味的有机物组成的混合物。相关物质转化关系如下:
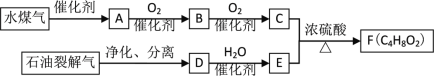
(1)A的官能团的名称____,D的结构简式____。
(2)B→C的化学方程式是____。
(3)F的同分异构体中能与NaOH溶液反应的有____种(包括F自身)。
(4)下列说法正确的是____。
A 石油裂解气和B都能使酸性KMnO4褪色
B 可以用碳酸钠溶液洗去C、E和F混合物中的C、E
C 相同物质的量的D、E或F充分燃烧时消耗等量的氧气
D 有机物C和E都能与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 保存FeCl2溶液时,应在试剂瓶中加入少量铁粉
B. 焰色反应时,铂丝需用稀硫酸洗净,并在火焰上灼烧至无色
C. 蒸馏时加入沸石的目的是为了防止暴沸
D. 使用容量瓶配制溶液定容时仰视刻度线会使得所配溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族,Y、Z的原子最外层电子数之和等于9,X 的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. 简单离子半径:Y>W>Z
B. W 的氧化物对应的水化物的酸性一定比X 的强
C. Y的简单气态氢化物的热稳定性一定比W的强
D. Y 分别与X、Z形成的化合物,其所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分) 氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:
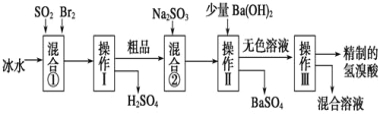
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________________________________。
(2)混合①中使用冰水的目的是___________ ______________________。
(3)操作Ⅱ和Ⅲ的名称分别是________、__________。操作Ⅲ一般适用于分离_______混合物(选填编号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。 于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________,若假设成立可观察到的现象为____________________________。乙同学假设工业氢溴酸呈淡黄色是因为_____________________________,其用于证明该假设所用的试剂为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com