
| A、原子半径:丙<丁<乙 |
| B、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
| C、甲、乙、丙的氧化物均为共价化合物 |
| D、单质的还原性:丁>丙>甲 |


科目:高中化学 来源: 题型:
| A、含有共价键的化合物不一定是共价化合物 |
| B、单质分子中,一定存在着共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、在共价化合物中,一定存在着共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔质量就等于物质的式量 |
| B、硫酸和磷酸的摩尔质量相等 |
| C、HNO3的摩尔质量是63g |
| D、摩尔质量就是物质式量的6.02×1023倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何粒子集体都含有约6.02×1023个该种粒子 |
| B、0.012kg12C 含有约6.02×1023个碳原子 |
| C、1mol水中含有2mol氢元素和1mol氧元素 |
| D、1molNH3约含有6.02×1024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量Fe与1mol Cl2燃烧反应时,转移的电子数为3NA |
| B、1mol NO2与足量H2O反应,转移的电子数为NA |
| C、常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为0.2 NA |
| D、高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O6 |
| △ |
| 容器 | 温度(℃) | SO2(mol) | O2(mol) | 催化剂 |
| A | 500 | 10 | 5 | ----- |
| B | 500 | 10 | 5 | V2O5 |
| C | 450 | 8 | 5 | ----- |
| D | 500 | 8 | 5 | ----- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
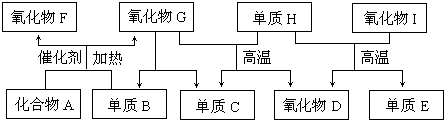
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- |
| B、氯气通入水中:Cl2+H2O═H++Cl-+ClO- |
| C、AlCl3溶液中通入过量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| D、Cl2通入烧碱溶液中:Cl2+OH-═Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com