
分析 ①依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸的体积,选择合适规格的量筒量取浓盐酸;
②据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
③根据盐酸和氢氧化钠之间反应量的关系来计算.
解答 解:①设需要浓盐酸的体积为V,则根据稀释定律,稀释前后溶质的物质的量不变得VmL×10mol/L=250mL×1mol/L,解得:V=25.0,应选择25mL量筒量取浓盐酸;
故答案为:25mL量筒;25.0;
②操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用25mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,
故答案为:胶头滴管;250mL容量瓶;
③250mL 1mol/L的稀盐酸中氯化氢的物质的量为1mol/L×0.25L=0.25mol;盐酸和氢氧化钠之间反应,量的关系是:NaOH~HCl,则消耗氢氧化钠的物质的量为0.25mol,其质量为:0.25mol×40g/mol=10.0g;
故答案为:10.0.
点评 本题考查学生配制一定体积一定物质的量浓度的溶液配制,明确配制原理及操作步骤是解题关键,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
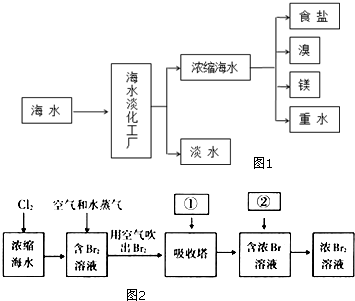 浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
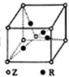 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
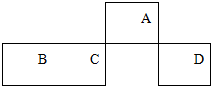 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )| A. | C元素在地壳中的含量仅次于氧元素 | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 元素A与元素B形成的化合物BA是一种新型无机非金属材料 | |
| D. | 实验室可用B的单质与A元素最高价氧化物对应的水化物反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
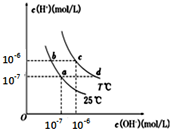
| A. | a点对应的溶液中大量存在:Na+、Mg2+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、Cl-、NO3- | |
| C. | c点对应的溶液中大量存在:K+、Al3+、Cl-、CO32- | |
| D. | d点对应的溶液中大量存在:Na+、NH4+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
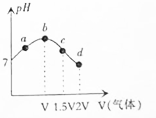
| A. | d点所示溶液中:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| B. | a点到b点的过程中,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | c点所示溶液中,c(CO32-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +135 KJ•mol-1 | B. | -375 KJ•mol-1 | C. | -325 KJ•mol-1 | D. | +325 KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com