
【题目】下列反应的离子方程式中,书写正确的是( )
A. 氢氧化铜与稀硫酸反应:OH-+H+===H2O
B. 铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. 氯化铝溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1) 为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:
①适当升高温度;②搅拌;③________等。
(2) 加入H2O2时发生主要反应的离子方程式为________________。
(3) “除铁”时,控制溶液pH的范围为______________。
(4) 滤渣B的主要成分的化学式为______________。
(5) 已知:Ksp(NiCO3)=1.42×10-7。为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>________mol·L-1。
(6) “氧化”生成Ni2O3的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于制备氢氧化铁胶体的正确操作方法是
A. 在氯化铁溶液中滴入氢氧化钠溶液 B. 加热煮沸氯化铁溶液
C. 把氯化铁溶液滴入热水中 D. 把饱和的氯化铁溶液逐滴滴入到沸水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若Y原子的最外层电子数是次外层电子数的3倍.下列说法错误的是( )
![]()
A. 气态氢化物的热稳定性:X<Y
B. 最高价氧化物对应水化物的酸性:W>Z>X
C. X、Y元素均存在同素异形体
D. W的单质具有漂白性,能使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨晶体由层状石墨“分子”按 ABAB方式堆积而成,如右图(a)所示,并给出了一个石墨的六方晶胞如图(b)所示。

(1)每个晶胞中的碳原子个数为_________;
(2)在图中画出晶胞沿c轴的投影(用“●” 标出碳原子位置即可)________;
标出碳原子位置即可)________;
(3)假设石墨的层间距为300 pm,C-C键长为150 pm,计算石墨晶体的密度为_____ g·cm-3(碳元素的相对质量为12,NA=6.0×1023mol-1,计算结果保留一位小数);
(4)石墨可用作锂离子电池的负极材料,充电时发生下述反应: Li1-xC6+x Li++xe-→ LiC6 。其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。 在 LiC6中,Li+与相邻石墨六元环的作用力属_______键;
(5)某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明溶液中,能大量共存的离子组是
A. K+、MnO4―、SO42―B. Al3+、Cl―、SO42―
C. Na+、CH3COO―、H+D. OH―、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲烷化再利用。
请回答:
⑴已知:2Al2O3(s)=4Al(g)+3O2(g) △H1=3351 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-221 kJ·mol-1
2Al(g) + N2(g)=2AlN(s) △H3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是_____,该反应自发进行的条件____________。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
反应II CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2

①下列说法不正确的是_____
A. △H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为________(用a、V表示)。
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。________

据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
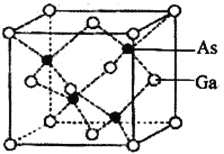
【题目】氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)基态磷原子有________种不同能量的电子。
(2)N、P、As电负性由大到小的顺序为 ______ ,它们的氢化物沸点最高的为_______________,原因为___________________________。
(3)NO3- 离子的空间构型为_____,中心原子的杂化方式为_____ ,NO3-离子有多种等电子体,请写出一种_________ 。
(4)钛元素原子核外价电子排布图为____________,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型为____________,该配离子的配位数为____________。
(5)砷化镓晶胞结构如下图。晶胞中距离Ga原子等距且最近的Ga原子有_________个,Ga与周围等距且最近的As形成的空间构型为____________。已知砷化镓晶胞边长为a pm,其密度为ρgcm-3,则阿伏加德罗常数的数值为_____________(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com