
| A、醋酸的电离:CH3COOH+H2O?CH3COO-+H3O+ |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、CaCO3的电离方程式:CaCO3?Ca2++CO32- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、实验②证明Fe2+既有氧化性又有还原性 |
| B、实验③生成的气体不能使湿润的淀粉KI试纸变蓝 |
| C、上述实验中,有三个氧化还原反应 |
| D、上述实验证明氧化性:MnO2>MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、向NaAlO2溶液中通入少量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、过量的二氧化碳与氢氧化钠反应:CO2+OH-=HCO3- |
| D、少量的氢氧化钠和碳酸氢钙反应:Ca2++2HCO3-+OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在FeCl2溶液中滴入NaOH溶液 | 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
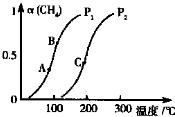 天然气在工农业生产中具有重要意义.
天然气在工农业生产中具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com