
【题目】设阿伏加德罗常数的值为NA、利用反应2MgO+Si![]() 2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
A.消耗的MgO质量为40gB.断裂Si-Si键的数目为NA
C.转移的电子数为2NAD.生成镁蒸气体积为22.4L
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6] 目前广泛用作食品添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如下:
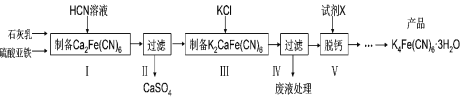
回答下列问题:
(1)步骤I反应的化学方程式为______。
(2)步骤IV过滤所得的废液中含量较多的溶质为______(填化学式)。
(3)步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6,所用的试剂X是_____。(填名称)
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
①25°C时Ka(HCN)=6.25×10-10;计算25℃时0.01molL-1的HCN溶液的pH=____(lg2.5=0.4)。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN;第二步控制pH为7.58.5,用NaClO溶液完全氧化OCN生成N2和两种盐(其中一种为酸式盐)。
第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
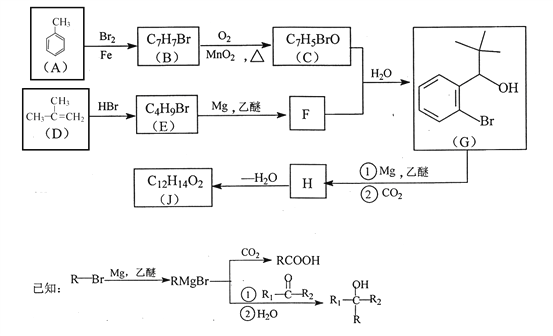
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是
A.加入催化剂,反应速率加快,反应的![]() 变大
变大
B.将平衡后的混合气体用浓硫酸吸收,剩余的气体只有![]()
C.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
D.若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是a、b两种固体物质的溶解度曲线。下列说法中正确的是
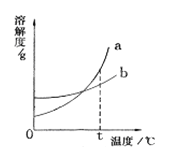
A. a物质的溶解度受温度变化的影响较小,b物质的溶解度受温度变化的影响较大。
B. t℃时,等质量的a、b饱和溶液中含有相同质量的溶质
C. 当温度大于t℃时,a溶液一定比b溶液浓
D. a中含有少量b时,用冷却热饱和溶液的方法提纯a。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
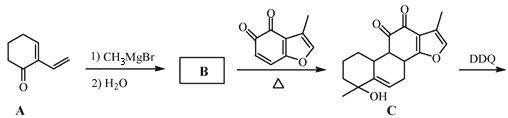
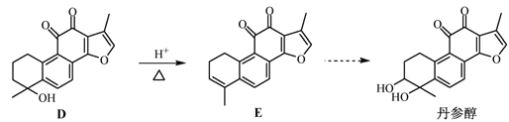
已知:①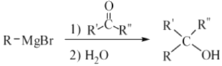 ②
②![]()
(1)A中的官能团名称为羰基和_______________。
(2)D![]() E的反应类型为__________反应。
E的反应类型为__________反应。
(3)B的分子式为C9H14O,则B的结构简式为_______________。
(4)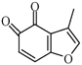 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱中有4个吸收峰,峰面积比为1:1:2:2。
(5)请补全以![]() 和
和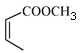 为原料制备
为原料制备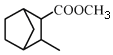 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
![]() 中间产物①__________
中间产物①__________![]() 中间产物②__________
中间产物②__________![]() 中间产物③__________反应物④ _______反应条件⑤__________
中间产物③__________反应物④ _______反应条件⑤__________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
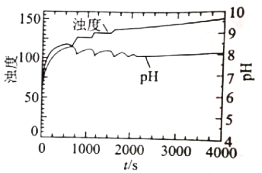
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的热量。其他相关数据如下表:则表中 x 为( )
O=O | H-H | H-O(g) | |
1mol 化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
A.920B.557C.463D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H1
H2O(g) △H1
![]() N2(g)+O2(g)
N2(g)+O2(g)![]() NO2(g) △H2
NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) △H3
NH3(g) △H3
则反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的△H为( )
A.△H1+△H2+△H3B.2△H1+2△H2-2△H3
C.6△H1+4△H2+4△H3D.6△H1+4△H2-4△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com