
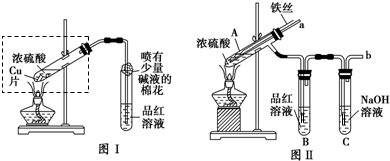
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。


 图1
图2
图1
图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是 。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有 的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为 mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴 ,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为 mol·L-1。
③甲、乙两方案比较,你认为误差较大的是 ,理由是 。
(1)①能更好地吸收有毒气体SO2,防止其污染环境
②停止加热时,能防止倒吸或平衡压强
③通过铜丝的上下抽动可以控制反应的发生和停止 。
(2)①随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。
②A D
(3)从导管口向A中大量鼓气 。
(4)①碱石灰; [18-25m/8] 。
②甲基橙; 0.25v 。
③甲; 被碱石灰吸收的除了SO2外还有水蒸气,导致SO2的质量偏大,计算出的余酸浓度偏小。
【解析】
试题分析:
(1)比较两实验装置,图2装置的优点是:①通过铜丝的上下抽动可以使反应随时发生,也可以是反应随时停止,这样就可以控制化学反应的进行;②用品红溶液检验后用NaOH来吸收SO2,可以减少有毒气体的排放,更环保。③由于在图2装置中有一根玻璃导管。当停止加热时,它能平衡压强,这样就可以防止倒吸现象的发生。
(2)①Cu与浓硫酸发生反应:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。因此还有一定量的硫酸剩余。②A、若有硫酸剩余,则加入Fe粉时会发生反应:Fe+H2SO4=FeSO4+H2↑。冒气泡。正确。B.无论是否有硫酸剩余,在溶液中都含有SO42-,加入氯化钡溶液时发生反应:Ba2++ SO42-=BaSO4↓。产生白色沉淀。错误。C. 在金属活动性顺序表中Ag在H的后面,不能把酸中的H置换出来。错误。D.酸性H2SO4
>H2CO3 ,所以加入碳酸氢钠溶液时发生反应H2SO4+
2NaHCO3=Na2SO4+2H2O+2CO2↑。冒气泡。正确。故正确选项为A
、D。
CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。因此还有一定量的硫酸剩余。②A、若有硫酸剩余,则加入Fe粉时会发生反应:Fe+H2SO4=FeSO4+H2↑。冒气泡。正确。B.无论是否有硫酸剩余,在溶液中都含有SO42-,加入氯化钡溶液时发生反应:Ba2++ SO42-=BaSO4↓。产生白色沉淀。错误。C. 在金属活动性顺序表中Ag在H的后面,不能把酸中的H置换出来。错误。D.酸性H2SO4
>H2CO3 ,所以加入碳酸氢钠溶液时发生反应H2SO4+
2NaHCO3=Na2SO4+2H2O+2CO2↑。冒气泡。正确。故正确选项为A
、D。
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是从导管口向A中大量鼓气 。
(4)①由于SO2是酸性气体,能与碱发生反应,所以在甲方案:将产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,反应结束后再次称量,干燥管质量增加m g。n(SO2)=(64/m)mol,反应消耗的硫酸的物质的量为(32/m)mol.剩余的硫酸物质的量浓度为{18×10-2mol-(32/m)mol}÷10-2L=(18-25m/8)mol/L。
②乙方案:由于氢氧化铜开始沉淀的pH约为5甲基橙的变色范围为3.1~4.4.酚酞的变色范围是8.2~10.所以为了减少实验误差,在酸碱中和滴定时选择的指示剂为甲基橙。此时只发生酸碱中和反应。取20.00 mL稀释后的溶液。用0.1000mol/L标准NaOH溶液进行滴定用去NaOH溶液V mL。n(NaOH)= V×10-4mol.剩余硫酸的物质的量为n(H2SO4)= 5V×10-5mol,所以其余酸浓度为(1 000 mL÷20.00 mL) 5V×10-5mol ÷0.01L=0.25v mol/L。
③甲、乙两方案比较,误差较大的是甲;因为该反应发生时产生的SO2气体中含有水蒸气,被碱石灰吸收的除了SO2外还有水蒸气,导致SO2的质量偏大,则计算出的余酸浓度偏小。
考点:考查铜与浓硫酸的反应方案的评价、实验操作、误差分析、酸碱中和滴定的指示剂的选择、计算等。


科目:高中化学 来源: 题型:
 某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.
某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.| 实验编号 | 实验操作 | 实验现象 |
| 1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
| 2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 所选试剂 | 现象及结论 |
| 1 | ||
| 2 | ||
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

【实验探究】
(1)探究浓硝酸的强氧化性
将过量铜片置于具支试管的底部,通过分液漏斗往具支试管中加入少量浓硝酸,用排水法收集产生的气体。
①在具支试管中观察到实验现象是__________________________________。
②具支试管中发生反应的化学方程式为:____________________________。
(2)探究稀硝酸的强氧化性
①上述反应完成后,欲进一步探究稀硝酸的强氧化性,紧接着简便、合理的实验操作是:
________________________________________________________。
②能证明稀硝酸与铜反应的还原产物为NO的实验现象是______________(填标号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
【实验反思】
(1)某同学提出,实验过程中若操作不慎,易出现倒吸现象。对该实验装置进行改进的方案是:可在b与c之间连接____________________________(填装置的名称)。
(2)利用该装置先进行铜与浓硝酸的反应,再进行铜与稀硝酸反应的实验顺序的合理性是:
_____________________________________________________________________。
【问题讨论】
在用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)分别反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。针对此现象,同学们进行讨论,提出两种意见:
①认为两溶液所显颜色不同的原因,是因为Cu2+浓度的差异引起的。
②认为前者溶液呈绿色是因为生成的红棕色NO2气体溶解于溶液中引起的。
你认为上述意见______________(填“①”或“②”)合理。(注:若选填①,下题中只答Ⅰ;若选填②,下题中只答Ⅱ)Ⅰ.如果你认为合理,理由是____________________________。
Ⅱ.如果你认为合理,请设计一个简单的实验进行验证:____________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市通州区高三年级上学期期末摸底考试化学试卷(解析版) 题型:实验题
某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。


请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
|
步骤 |
所选试剂 |
现象及结论 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
查看答案和解析>>
科目:高中化学 来源:福建省福州三中2010-2011学年高三年级第二次月考 题型:实验题
盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反
应情况,填空回答下列问题:
(1)我们知道,稀盐酸不与Cu反应,但在稀盐酸中加入H2O2后,则可使铜顺利溶解,该反应的化学方程式为_ 。
(2)在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为
0.9mol。则浓硫酸的实际体积____ (填写“大于”、“等于”、或“小于”)100mL,你认为其主要原因是 。
若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈
绿色,后者呈蓝色,某同学提出这可能是溶液中Cu2+与NO2共存的结果,请你设
计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com