
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是 ( )
A.焓变 B.温度 C.压强 D.熵变
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。
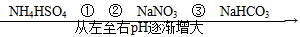
图中①②③可能是( )
A.NH4NO3、(NH4)2SO4、CH3COONa
B.(NH4)2SO4、NH4Cl、C6H5ONa
C.(NH4)2SO4、NH4NO3、Na2CO3
D.(NH4)2SO4、NH4NO3、CH3COONa
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
ABCD
强电解质FeNaClCaCO3HNO3
弱电解质CH3COOHNH3H3PO4Fe(OH)3
非电解质C12H22O11(蔗糖)BaSO4C2H5OHH2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:填空题
一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)K和x的关系满足K=________。在保证A浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(2)若该反应的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时________________;
t8时________________;
②t2时平衡向________(填“正反应”或“逆反应”)方向移动;
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是( )
Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是( )
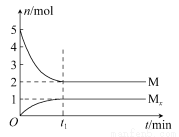
A.该反应的化学方程式是2HF (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:实验题
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2%H2O2溶液 | 无 |
② | 10 mL 5%H2O2溶液 | 无 |
③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是________(填一种即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。

(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量________或________来比较;
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物质的量浓度为________。(保留两位有效数字,在标准状况下测定)

Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸,10 s时收集产生的H2体积为50 mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为______g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是 ( )
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是 ( )
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) ;
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可) 。
(3)已知常温下1 g①单质在④单质中燃烧生成稳定的液态物质时放出142.9 kJ热量,则表示①单质燃烧的热化学方程式为 。
(4)①②形成的最简单的化合物与④单质在KOH作电解质溶液时可形成原电池,其中负极的电极反应为 。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为 ;
②N→⑥的单质所采用的方法是 ;
③M溶液呈酸性,原因是(用离子方程式解释) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com