
| A、新制氯水与碳酸氢钠不反应 |
| B、25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C、25℃时,等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pHpH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
| D、25℃时,PH=9的NaHCO3溶液中:C(HCO3-)>C(CO32-)>C(H2CO3) |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
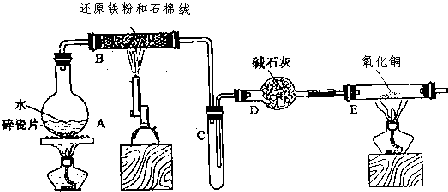
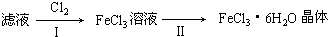
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
 为碳原子,
为碳原子, 为硅原子).每个碳原子周围与其距离最近的硅原子有
为硅原子).每个碳原子周围与其距离最近的硅原子有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②⑥ | C、② | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、①③ | C、①③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1 | B、2:5 |
| C、11:3 | D、4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com