
������������ȷ����
�ٱ�״���£�1 L HCl��1 L H2O�����ʵ�����ͬ
�ڱ�״���£�1 g H2��14 g N2�������ͬ
��28 g CO�����Ϊ22.4 L
���������ʵ����ʵ�����ͬ���������ڱ�״���µ����Ҳ��ͬ
����ͬ��ͬ���ʱ���������ʵ����ʵ���Խ����ѹǿԽ��
��ͬ��ͬѹ�£�������ܶ����������Է�������������
A���٢ڢ� B���ڢݢ� C���ڢۢ� D���ܢݢ�
B
��������
����������ٱ�״���£�ˮ�������壬����1 L HCl��1 L H2O�����ʵ�������ͬ�����ڱ�״���£�1 g H2�����ʵ�����0.5mol��14 g N2�����ʵ���Ҳ��0.5mol�����ݰ���٤�����ɣ���ͬ�����£����ʵ�����ͬ���κ�����������ͬ����ȷ����28 g CO�����ʵ�����1mol����δָ����״�������������һ��Ϊ22.4 L�������������ʵ����ʵ�����ͬ���������ڱ�״���µ������һ����ͬ�������߶�������ʱ�������ͬ��������ͬ��ͬ���ʱ���������ʵ����ʵ���Խ����ѹǿԽ����ȷ����ͬ��ͬѹ�£������Ħ�������ͬ������������ܶ����������Է������������ȣ���ȷ����ѡB��
���㣺�������٤�����ɵ�����Ӧ��


 ȫ��������ϵ�д�
ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ����10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ����ѡ��4 �л���ѧ��������15�֣�
��ϩ��һ����Ҫ�Ļ���ԭ�ϣ�����ϩΪԭ�����������ֻ�����Ʒ�ķ�Ӧ���£����ַ�Ӧ��������ȥ����
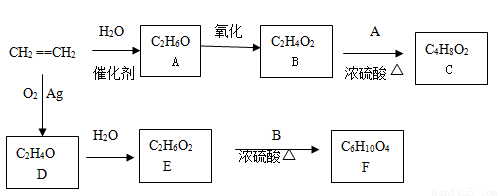
��ش��������⣺
��1��д��A��ʵ��������ϩ�ķ���ʽ�� ��
��2��B��E��Ӧ����F�Ļ�ѧ����ʽΪ______ _____���÷�Ӧ������Ϊ_____________��
��3��D�Ľṹ��ʽΪ____ _______��
��4��д��D��ͬ���칹�壨��ȩ��������������Ӧ�Ļ�ѧ����ʽ��
��5��C��ͬ���칹���к�ȩ���Ľṹ�� �֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ��������ѧ�Ծ��������棩 ���ͣ������
��15�֣�ͭ���仯�������������������й㷺��Ӧ�á�
��1��ͭ�ɲ������·����Ʊ���
����ͭ��Cu2S+O2  2Cu+SO2
2Cu+SO2
ʪ����ͭ��CuSO4+Fe  FeSO4+Cu
FeSO4+Cu
�������ַ����У�ͭԪ�ؾ���_____ _____ (����������ǡ���ԭ��)��ͭ���ʡ�
��2��ӡˢ��·����ʹ�õ�ͭ��Ҫ�������á�
��FeCl3��Һ����ӡˢ��·���Ʊ�CuCl2��2H2O��ʵ����ģ����չ������£�

�ٲ���1�з�Ӧ�����ӷ���ʽ��______ _________��
�ڲ���2���ӵ������������˵���____________ ________��
A��HNO3 B��H2O2 C��KMnO4
�۲���3��Ŀ����ʹ��Һ��pH���ߵ�5����ʱFe3+Ũ��Ϊ____ ______
[Ksp(Fe(OH)3)=4��10-38]����ѡ�õġ��Լ�1����____ ______(д��һ�ּ���)��
������Ũ��CuCl2��Һʱ��Ҫ�μ�Ũ���ᣬĿ����__________ _____________ (�û�ѧ����ʽ����ϼ�Ҫ������˵��)���پ���ȴ���ᾧ�����ˣ��õ�CuCl2��2H2O��
��3����ʵ�ַ�ӦCu+H2SO4(aq)��CuSO4+H2����������Ϊ��ʵ�ָ�ת����װ���е������ڣ�����缫����(��
��Cu����C��)����д���缫��Ӧʽ��
��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ������
A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Ag����Na�� |
������ | NO3����SO42����Cl�� |
��ͼ����ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A�� B�� C������Һ���缫��Ϊʯī�缫����ͨ��Դ������һ��ʱ��������c�缫����������27 g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ����ͼ����ʾ���ݴ˻ش��������⣺
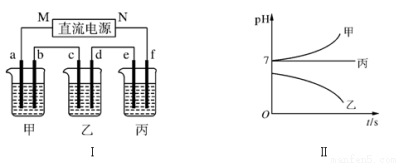
��1��MΪ��Դ��________(���������)����A��________(��д��ѧʽ)��
��2������缫f�����ɵ������ڱ�״���µ������________��
��3��д�����ձ��ĵ��ط�Ӧ��________________________________________________��
��4��Ҫʹ���ָ���ԭ����״̬��Ӧ����________ g ________(��д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ϳɰ���Ӧ��N2(g)��3H2(g)  2NH3(g) ��H<0���ڷ�Ӧ�����У��淴Ӧ���ʵı仯����ͼ��ʾ������˵����ȷ����(B)
2NH3(g) ��H<0���ڷ�Ӧ�����У��淴Ӧ���ʵı仯����ͼ��ʾ������˵����ȷ����(B)
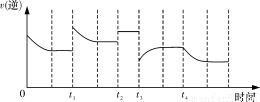
A��t1ʱһ���������������� B��t2ʱʹ���˴���
C��t3ʱ������ѹǿ D��t4ʱһ���ǽ������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ������������Һ�д����������������
�ٺ��д���Al3������Һ�У�Na����NH4+��SO42����Cl��
�ڼ���Al�ܷų�H2����Һ�У�Cl����HCO3����SO42����NH4+
�ۺ��д���Fe3������Һ�У�Na����Mg2����NO3����SCN��
���ں��д���AlO2������Һ�У�NH4+��Na����Cl����H��
����ˮ�������c(H��)��1��10��14mol��L��1����Һ�У�Ca2����K����Cl����HCO3��
A���٢� B���٢ۢ� C���� D���٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�������
������(8��)
��1��1�������Ļ�Ϸ�ĩ����200mL��5mol/L�������У���Ӧ�������Ũ�ȱ�Ϊ4��6mol/L����������Һ����ı仯���Լ��㣺
��1��ԭ���������������������Ϊ���٣�
��2����Ӧ������������ڱ�״���µ�������٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ɫ����ǿ������Һ�п��Դ����������������
A��Na+��NO3-��Mg2+��Cl- B��Na+��CO32-��NO3-��Ca2+
C��K+��Cl-��SO42-��Cu2+ D��Ba2+��Cl-��K+��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ�ѡ����
�������һ�����ᣬ��������ʴ��������֪25��ʱ��
HF(aq) + OH��(aq) 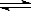 F��(aq) + H2O(l) ��H=��67.7 kJ/mol
F��(aq) + H2O(l) ��H=��67.7 kJ/mol
H+(aq) + OH��(aq) 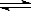 H2O(l) ��H=��57.3kJ/mol
H2O(l) ��H=��57.3kJ/mol
��10 mL 0.1mol/L��NaOH��Һ�У�����10 mL Ũ��Ϊc mol/L��HFϡ��Һ������˵���д������
A�����������Һ�¶����ߣ�HF�ĵ���̶ȼ�С�������ǻӷ���
B��ˮ������Ȼ�ѧ����ʽΪ��H2O(1) 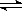 H+(aq)+OH��(aq)����H= +57.3kJ/mol
H+(aq)+OH��(aq)����H= +57.3kJ/mol
C����c > 0.1ʱ��һ�������ڣ�c(Na+) = c(F��)
D������Ϻ���Һ�У�c(Na+)>c(OH��) >c(F��)>c(H+)����cһ��С��0.1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com