
【题目】(1)油酸的化学式为![]() ,其结构中含有
,其结构中含有![]() 、和
、和![]() 两种官能团,则通过实验检验
两种官能团,则通过实验检验![]() 的方法是__________;通过实验检验
的方法是__________;通过实验检验![]() 的方法是______。
的方法是______。
(2)![]() 某种油脂发生氢化反应,需标准状况下氢气的体积为
某种油脂发生氢化反应,需标准状况下氢气的体积为![]() ;等物质的量的该油脂氢化后,再发生皂化反应共消耗
;等物质的量的该油脂氢化后,再发生皂化反应共消耗![]() 。若该油脂是简单甘油酯,则它的结构可表示为______。
。若该油脂是简单甘油酯,则它的结构可表示为______。
【答案】向油酸中加入溴水,溴水褪色 向油酸中加入含酚酞的![]() 溶液,溶液的红色变浅
溶液,溶液的红色变浅 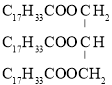
【解析】
油脂是高级脂肪酸的甘油酯,结构中含有酯基;1mol油脂含3mol酯基,1mol油脂水解消耗3molNaOH。
(1)碳碳双键能与溴发生加成反应而使溴水褪色,可以向油酸中加入溴水,振荡,溴水褪色,证明油酸中含有碳碳双键。-COOH有酸性,可以向油酸中加入含酚酞的![]() 溶液,充分振荡,溶液红色变浅,可证明油酸中含有羧基,故答案为:向油酸中加入溴水,溴水褪色;向油酸中加入含酚酞的
溶液,充分振荡,溶液红色变浅,可证明油酸中含有羧基,故答案为:向油酸中加入溴水,溴水褪色;向油酸中加入含酚酞的![]() 溶液,溶液的红色变浅;
溶液,溶液的红色变浅;
(2)![]() 的物质的量为
的物质的量为![]() ,水解消耗的NaOH的物质的量=
,水解消耗的NaOH的物质的量=![]() ,该油脂的物质的量为
,该油脂的物质的量为![]() ,则1个该油脂分子中所含碳碳双键数=
,则1个该油脂分子中所含碳碳双键数=![]() 。油脂的摩尔质量
。油脂的摩尔质量![]() 。因为该油脂是简单甘油酯,结合分子中含三个碳碳双键可设该油脂为
。因为该油脂是简单甘油酯,结合分子中含三个碳碳双键可设该油脂为![]() ,则
,则![]() ,解得
,解得![]() ,所以该油脂的结构简式为:
,所以该油脂的结构简式为: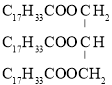 ,故答案为:
,故答案为: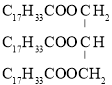 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
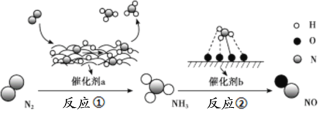
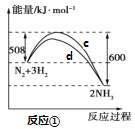
下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
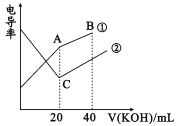
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________、中心原子的杂化形式为________。LiAlH4中,存在_________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
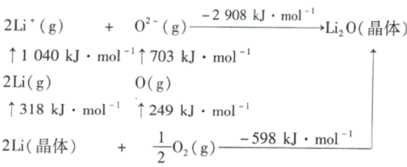
可知,Li原子的第一电离能为_________kJ·mol-1,O=O键键能为__________ kJ·mol-1,Li2O晶格能为_________ kJ·mol-1
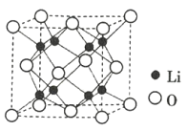
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加德罗常数的值为NA,则Li2O的密度为___________g·cm-3(列出计算式)。
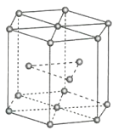
(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为______ g·cm-3(列出计算式)。
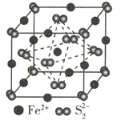
(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是______________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________。
GeCl4 | GeBr4 | Gel4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__________,微粒之间存在的作用力是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C(
);C(![]() ,0,
,0,![]() ),则D原子的坐标参数为_________。
),则D原子的坐标参数为_________。
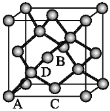
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 氨基酸在一定条件下能与亚硝酸
氨基酸在一定条件下能与亚硝酸![]() 反应得到
反应得到![]() 羟基酸,如下:
羟基酸,如下:
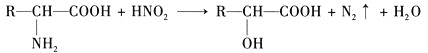
试根据如图所示关系回答下列有关问题。
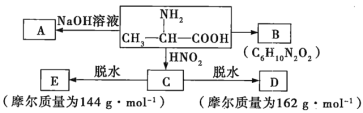
(1)写出A、B的结构简式:A_________;B_________。
(2)![]() 的化学方程式为________。
的化学方程式为________。
(3)![]() 的化学方程式为________。
的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
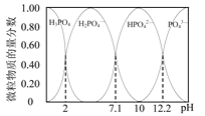
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种有机物互为同系物,下列有关说法错误的是( )
A.若X为![]() ,则Y不可能是
,则Y不可能是![]()
B.若X是甲醇、Y是乙醇,则Z一定能发生消去反应
C.若X为苯,Y为甲苯,则Z的相对分子质量一定不低于106
D.若X、Y均是饱和一元醛,则Z的分子式一定不是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com