
| A. | 32g氧气与足量锂完全反应得到的电子数为2NA | |
| B. | 在1L2mol•L-1MgCl2溶液中含有的Cl-数为2NA | |
| C. | 标准状态下,2.24LCO2与2.24LH2O中所含原子数均为0.3NA | |
| D. | 标准状况下,11.2L氯气与足量NaOH溶液反应转移的电子数为0.5NA |
分析 A、求出氧气的物质的量,然后根据氧气和锂反应后变为-2价来分析;
B、求出氯化镁的物质的量,然后根据1mol氯化镁中含2mol氯离子来分析;
C、标况下水为液态;
D、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析.
解答 解:A、32g氧气的物质的量为1mol,而氧气和锂反应后变为-2价,故1mol氧气转移4mol电子即4NA个,故A错误;
B、溶液中氯化镁的物质的量n=1L×2mol/L=2mol,而1mol氯化镁中含2mol氯离子,故2mol氯化镁中含4mol氯离子即4NA个,故B错误;
C、标况下水为液态,故22.4L水的物质的量和22.4L二氧化碳的物质的量不同,则含有的原子数也不同,故C错误;
D、标况下11.2L氯气的物质的量为0.5mol,而氯气和碱的反应为歧化反应,故0.5mol氯气转移0.5NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 碳酸钙 | D. | 硫酸铜 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
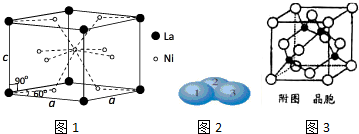
 小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.
小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 | |
| C. | 将稀硝酸加入过量铁粉中,充分反应后滴加硫氰化钾溶液,有气体生成溶液呈血红色,说明稀硝酸将铁氧化为正三价铁离子 | |
| D. | 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,熔化后的液态铝不会滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段表示电解水 | |
| D. | CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
氧化还原反应与四种基本类型反应的关系如 图所示,则下列化学反应属于阴影部分的是
图所示,则下列化学反应属于阴影部分的是
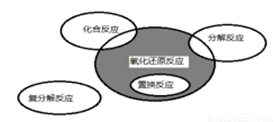
A. CuSO4+Mg=Cu+MgSO4
CuSO4+Mg=Cu+MgSO4
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.2Na2O2+2CO2=2Na2CO3+O2
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com