
| A、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
| B、64g的铜发生氧化还原反应,一定失去2NA个电子 |
| C、常温常压22.4L NO气体的分子数小于NA |
| D、标况时,22.4L二氯甲烷所含有的分子数为NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 17g |
| 17g/mol |
| m |
| M |
| 64g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、加热的温度二者不同 |
| B、获得的产品二者不同 |
| C、前者是物理变化,后者是化学变化 |
| D、前者不需要隔绝空气,后者需隔绝空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3Cl2+6KOH═5KCl+KClO3+3H2O |
| B、2FeBr2+3Cl2═2FeCl3+2Br2 |
| C、SnCl4+2H2O═SnO2+4HCl |
| D、Ca(OH )2+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳酸镁晶须是一种新型的吸波隐形材料中的增强材料.已知某碳酸镁晶须样品的组成为MgCO3?nH2O (n为1~5的正整数),通过对其进行热重分析得到如图所示的热重曲线,试根据曲线计算n=
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料.已知某碳酸镁晶须样品的组成为MgCO3?nH2O (n为1~5的正整数),通过对其进行热重分析得到如图所示的热重曲线,试根据曲线计算n=查看答案和解析>>
科目:高中化学 来源: 题型:
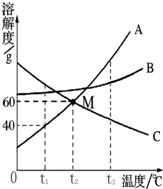 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、蛋白质都属于天然高分子化合物 |
| B、强紫外线灼伤人体皮肤属于皮肤蛋白质的变性 |
| C、纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 |
| D、向鸡蛋清溶液中分别加入饱和(NH4)2SO4和CuSO4溶液都能使之聚沉,其原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com