
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为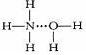 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(Na+) |
| A、升温 |
| B、加水稀释 |
| C、加少量的KOH固体 |
| D、加少量固体Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
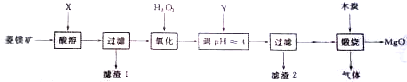
查看答案和解析>>
科目:高中化学 来源: 题型:
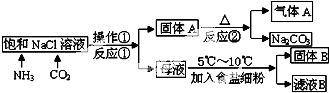
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Cu中Cu原子堆积方式为面心立方最密堆积,每个Cu原子的配位数均为12 |
| B、晶体的熔点:SiC>CCl4>P4>SO2 |
| C、酸性:HClO4>HClO3>HClO |
| D、晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若ω1=2ω2,则c1<2c2,V=100ml |
| B、若ω1=2ω2,则c1>2c2,V=100ml |
| C、若c1=2c2,则ω1<2ω2,V>100ml |
| D、若c1=2c2,则,ω1=2ω2,V=100ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
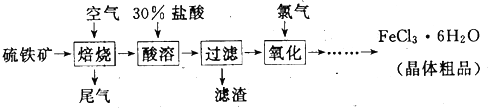
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com