
【题目】下列关于氯气的说法不正确的是( )
A. 氯气和液氯是两种不同的物质
B. 可以用浓硫酸除去氯气中的水蒸气
C. 氯气是一种有毒气体,但可用于自来水的杀菌消毒
D. 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________kJ·mol-1。标准状况下的煤气(CO、H2)33.6 L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO、H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为_________,则该电池的正极反应式是____________。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
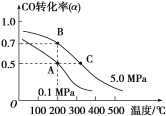
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10 L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10 L(填“大于”“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有(请配平)
_____Cl2+ Fe(OH)3+ KOH![]() K2FeO4+ KCl+ H2O
K2FeO4+ KCl+ H2O
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有 Fe3+ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe3+、Fe2+、CO32-、SO32-、Cl-、SO42-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在PH 试纸上,试纸呈红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B,在瓶口又慢慢变为红棕色
③向溶液A 中加入过量的NaOH 溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;
④向F溶液中通入过量的CO2,有白色沉淀G生成。请回答:
(1)G的化学式为:___________________________。
(2)检验气体C的方法_____________________;
(3)步骤②中反应的离子方程式为:_________________________;
(4)步骤3③中反应的离子方程式为:_______________________________;
(5)X溶液中一定含有的离子是_______________________________;在不能确定是否含有的离子中,若要确定其中一种,补做的实验是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是
A.被还原的物质是还原剂
B.氧化剂被还原,还原剂被氧化
C.失去电子,化合价降低的物质是还原剂
D.氧化剂失去电子,化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H 2 还原 WO3 制备金属 W 的装置如下图所示(Zn 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法错误的是

A. 反应开始时,先加热管式炉,再打开活塞 K
B. 往盐酸中加入少量 CuCl2,可加快产生 H2 的速率
C. ①、②、③中依次盛装 KMnO4 溶液、焦性没食子酸溶液、浓 H2SO4
D. 装置 Q(启普发生器)也可用于石灰石与盐酸反应制二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列碱性透明溶液中,能大量共存的离子组是
A.K+、Na+、MnO4-、Cl-B.K+、Ag+、NO3-、Cl-
C.Ba2+、Na+、Cl-、SO42-D.Na+、Cu2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2 C(s)+O2(g)═CO2(g)△H3
则反应4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H的表达式为_____
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。


则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=_____。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com